IsoPlexis又添多篇高分文献,多领域百花齐放!
随着IsoPlexis的产品获得越来越多科研工作者的认可,使用IsoPlexis功能蛋白质组学技术发表的文献数量也呈现明显上升趋势,包括Nature、Cell、Immunology、Gastroentrology等顶级期刊。接下来,让小编带大家回顾一下10月使用IsoPlexis功能蛋白质组学技术的文献精选,涵盖了细胞治疗、器官移植多个领域。
01
文献一
单细胞分析揭示了针对实体瘤的细胞治疗产品多功能性的增加
发表期刊:
《Cancer Immunology Research》影响因子12.02


随着新的CAR-T细胞的研发,研究人员必须对这些细胞的功能进行定性和评估,以更好地了解它们的工作原理。细胞产品是异质的,在单细胞水平上评估生物功能是至关重要的,因为群组水品的分析是平均的群体特征,可能会错过单个细胞中的关键功能指标。IsoPlexis的单细胞分泌组解决方案为研究人员提供了一个进行单细胞细胞因子分析的自动化平台,使他们能够轻松地对细胞进行功能表型,并对效力和持久性的关键生物标志物进行表征。
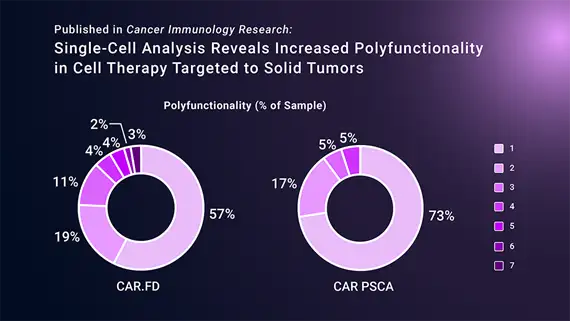
最近发表在《Cancer immunology research》上的一篇论文描述了为克服肿瘤微环境(TME)免疫抑制而设计的CAR-T细胞的特征。研究人员试图通过靶向Fas信号来防止TME中的T细胞功效丧失。通常情况下,作为对免疫激活的负反馈循环的一部分,Fas信号作用于调节T细胞的扩增和削弱免疫功能。实体瘤细胞可以通过表达Fas配体(FasL)与T细胞上的Fas受体结合并诱导细胞凋亡,或细胞死亡。FasL的表达已在各种实体瘤中被检测到,并被证明与疾病的进展、疾病严重程度和糟糕的治疗结果有关。
为了保护效应T细胞免受Fas信号通路的激活,研究人员设计了CAR-T细胞,当T细胞与特定抗原接触时,可以分泌Fas诱饵分子,从而防止Fas与FasL的相互作用。为了针对实体瘤,CAR-T细胞被设计为靶向一种由多种实体瘤表达的抗原——前列腺干细胞抗原(PSCA)。研究人员证实,PSCA刺激导致CAR-T细胞分泌Fas诱饵分子,这种分泌使CAR-T细胞免受Fas信号启动的影响。
接下来,研究人员想了解这种修饰如何影响细胞功能。利用IsoPlexis的单细胞分泌组平台,他们评估了细胞的多功能性,即细胞分泌两种或多种细胞因子的能力。用表达FasL的胰腺癌细胞刺激被修饰为分泌Fas诱饵(CAR.FD)的CAR-T细胞。与对照组的CAR-T细胞相比,CAR.FD细胞有更高比例的多功能细胞,一些细胞表达多达7种不同的细胞因子,而对照组细胞最多只表达4种细胞因子。
因为细胞的多功能性与改善细胞治疗产品效力、疗效和临床结果有关,在CAR.FD细胞中观察到的多功能性的增加是一个重要的效能指标,可以指导进一步的研究。随后的体外和体内实验显示,与对照组CAR-T细胞相比,表达Fas诱饵的CAR-T细胞能更有效地控制肿瘤生长。
02
文献二
单细胞功能分析外周血T细胞活性揭示器官排斥的机制
发表期刊:
《Journal of the American Society of Nephrology》影响因子:14.98

器官移植可以提高和延长受者的寿命,移植的过程常会伴随移植排斥;提高对移植组织和免疫系统之间的相互作用的认识,可以改善结果,降低排斥率。由于高达40%的肾脏移植在移植后10年内失败,研究人员正在寻找方法来审视排斥反应的机制,并改善肾脏移植者的移植后护理。鉴于免疫细胞及其功能的多样性,免疫反应是复杂的,细胞研究中的很多分析技术表征的是平均水平的信号,如细胞因子分泌水平或蛋白质表达水平的群组检测,这些结果将错过由于细胞异质性造成的关键的功能差异。单细胞分析让研究人员更好地了解每个细胞如何对免疫反应做出贡献,从而更深入地了解免疫功能。通过测量每个细胞的多达32种功能蛋白,IsoPlexis的单细胞分泌组平台提供了对免疫细胞进行功能表型的能力,并审视免疫反应的分子机制。
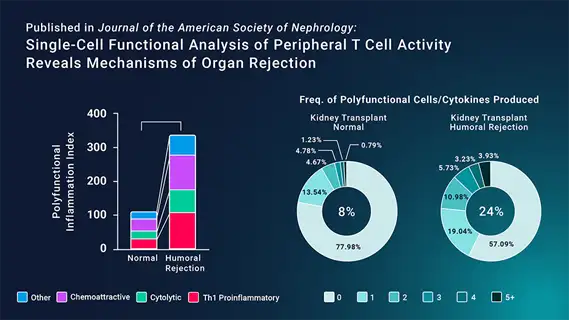
在最近发表于《Journal of the American Society of Nephrology》的一篇论文中,研究人员试图确定可能导致肾脏移植体液排斥的免疫因素。被称为终末分化效应记忆细胞或TEMRA细胞的CD8+记忆T细胞亚群,先前已被证明在其他类型的免疫相关疾病中具有致病性,包括狼疮、硬皮病和肾脏移植失败。研究人员使用了多种技术来研究CD8+记忆T细胞如何促进体液排斥。
为了描述CD8+T细胞的功能,研究人员使用IsoPlexis的单细胞分泌组平台,测量从有体液排斥和无体液排斥的肾移植受者血液中分离出来的细胞的分泌功能蛋白。与正常活检的受者相比,有体液排斥的受者的CD8+T细胞在CD3/CD28刺激后有明显表现出更强多功能性,即更多细胞能够分泌2种或更多细胞因子。多功能细胞此前已被确定为免疫反应的驱动因素,表明了排斥的一个可能机制。
作者进一步分析了受刺激的CD8+T细胞的细胞因子分泌物,发现有体液排斥反应的受者的促炎症(IFN-γ、TNF-α、MIP-1α和MIP-1β)和细胞毒性(颗粒酶B和穿孔素)细胞因子增加。这些细胞因子亚群的综合增加使研究人员相信,TEMRA CD8+ T细胞对免疫反应有贡献,这可能表明TEMRA CD8+ T细胞失调可能导致体液排斥。
其他实验显示,与其他T细胞亚群相比,来自体液排斥样本的TEMRA CD8+ T细胞具有更强的细胞毒性和迁移活性,这使研究人员得出结论,TEMRA CD8+ T细胞在体液排斥中发挥着积极作用。这些发现具有治疗意义,有助于降低肾脏移植受者的排斥率。
利用单细胞分析来确定免疫反应的驱动因素的意义表征移植中单个免疫细胞的功能,有助于改善临床结果,降低排斥反应率,并改善移植后的治疗。通过使用单细胞功能分析来确定关键的功能指标,包括细胞多功能性和多功能指数PSI,研究人员可以更好地了解单个免疫细胞如何协调免疫反应的工作。这项研究证明了细胞多功能性如何被用作外周T细胞功能的潜在非侵入性评估,显著分离出有和没有排斥反应的肾移植受者。IsoPlexis的单细胞功能表型为研究人员提供了一个强大的工具,以调查单个免疫细胞的功能,并揭示关键的功能驱动因素,提供独特的、可操作的见解,以推动新发现和改进疗法的开发。
IsoPlexis非常荣幸能为全球用户实现其研究目标并取得重大研究突破助力!IsoPlexis高效可靠的单细胞蛋白组学的技术服务避免了研究者盲目的方法学上的尝试,帮助更多科研、临床和医药研发的研究者快速推进研究项目!
点击原文可查看完整文献内容:
参考文献:
1. Bajgain P, et al. Secreted Fas decoys enhance the antitumor activity of engineered and bystander T cells in Fas ligand–expressing solid tumors. Cancer Immunol Res. 2022.
2. Ngoc TD, et al. Effector Memory–Expressing CD45RA (TEMRA) CD8+ T Cells from Kidney Transplant Recipients Exhibit Enhanced Purinergic P2X4 Receptor–Dependent Proinflammatory and Migratory Responses. J Am Soc Nephrol. 2022.
3. Amit M, et al. Distinct immune signature predicts progression of vestibular schwannoma and unveils a possible viral etiology. J Exp Clin Cancer Res. 2022.

