文献背景
蚜虫是世界上最具破坏性的农业和园艺害虫,以韧皮部为食,超过40%的植物病毒依靠蚜虫传播来感染植物,因此对作物生产造成了大规模的破坏。蚜虫侵害会诱导植物释放包含水杨酸甲酯(MeSA)、水杨酸结合蛋白-2(SABP2)、转录因子NAC2和水杨酸-羧甲基转移酶-1(SAMT1)在内的VOCs。MeSA在植物防御蚜虫等草食性昆虫侵害中发挥重要作用,包括驱除昆虫、吸引捕食者或降低昆虫的生存适应性等方式。MeSA被认为是植物内部和长距离移动信号,参与诱导对微生物病原体和食草昆虫的系统获得性抗性(SAR)。在SAR过程中,水杨酸(SA)在病原体感染的细胞中积累,并通过SAMT1转化为MeSA;然后,MeSA通过韧皮部进入远端组织,随后在未侵染叶中被SABP2重新转化为SA。虽然已知MeSA作为植物内SAR信号的功能,但MeSA如何作为植物间通讯的信号激活AD抗蚜虫防御是一个长期未解决的问题。植物是否拥有识别和感知空气中MeSA的受体也不清楚。此外,蚜虫和病毒能否干扰植物气传性免疫也未知。本研究揭示了AD的分子机制和蚜虫-病毒共同进化的共生关系,证明AD是控制蚜虫和病毒的潜在仿生策略。
基本信息
Molecular basis of methyl-salicylatemediated plant airborne defence
期刊:
Nature
影响因子:64.8
DOI:
https://doi.org/10.1038/s41586-023-06533-3
通讯作者:
刘玉乐
作者单位:
清华大学等
索莱宝合作产品:
|
产品货号 |
产品名称 |
|
|
6-苄氨基喋呤(6-BA) |
|
|
腺苷-5'-三磷酸 |
|
|
α-萘乙酸(NAA) |
摘要
蚜虫是世界上最具破坏性的作物害虫之一,被蚜虫侵害的植物会释放挥发性化合物,以引起邻近植物的气传性免疫(AD)。本文揭示了MeSA、SABP2、转录因子NAC2和SAMT1形成了信号通路来介导邻近植物针对蚜虫和病毒的AD。空气中MeSA能够被MeSA受体蛋白水杨酸结合蛋白-2(SA-binding protein-2,SABP2)感知并转化为水杨酸(salicylic acid, SA)。水杨酸引起信号转导级联反应,SA激活转录因子NAC2,上调水杨酸羧基甲基转移酶1(SA-carboxylmethyltransferase-1,SAMT1)基因的表达,激活NAC2-SAMT1模块从而产生更多的MeSA,诱导植物的抗蚜虫免疫,从而降低病毒的传播。一些蚜虫传播病毒比如黄瓜花叶病毒、马铃薯Y病毒等能够编码含有解旋酶结构域的蛋白质,通过与NAC2蛋白相互作用来抑制AD,改变NAC2蛋白的亚细胞定位,促进NAC2在细胞质中被26S蛋白酶体降解,从而负调控NAC2-SAMT1通路,抑制MeSA的合成和挥发,阻断植物间“预警”通讯,促进蚜虫对邻近植物的侵染和对病毒的传播。本研究揭示了AD的分子机制和蚜虫-病毒共同进化的共生关系,表明AD是一种潜在的生物仿生策略,可以控制蚜虫和病毒的传播。
研究内容及结果
作者通过免疫沉淀-质谱分析策略(IP-MS),成功鉴定了本氏猪笼草中黄瓜花叶病毒(CMV)的病毒发病机制过程中,核心蛋白CMV1a的相互作用蛋白组,并确定NAC2为CMV1a的重要相互作用因子,以进行后续实验(扩展数据图1a)。CMV1a-NAC2相互作用通过免疫共沉淀(co-IP)、双分子荧光(BiFC)和荧光素酶互补成像(LCI)试验进一步验证(扩展数据图1b-d)。为了评估NAC2是否影响CMV对NAC2.1/NAC2.2双敲除(KO)突变株的感染,通过比较CRISPR-cas9基因编辑(扩展数据图2a)产生的突变株(NAC2植株)和野生型(WT株)的感染结果,发现CMV感染导致NAC2突变株的症状更严重,病毒RNA和外壳蛋白(CP)的量更高(扩展数据图1e-g)。用GFP标记的马铃薯病毒Y或GFP标记的TMV(TMV-GFP)感染的突变株和野生型植株中也有类似的结果(扩展数据图1h-m)。这些数据表明,NAC2对植物抗病毒防御至关重要。 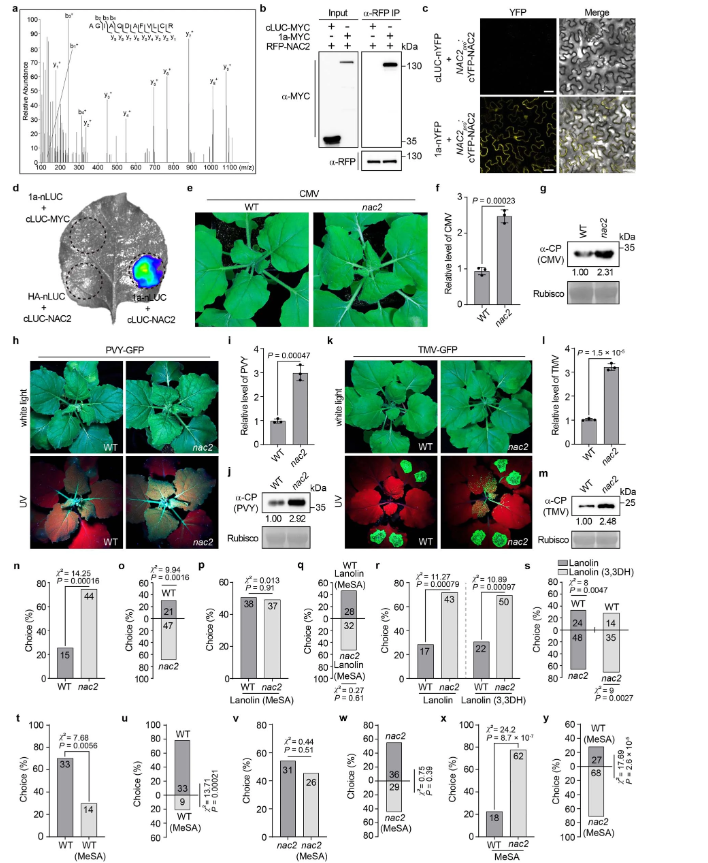
扩展数据图1
2. 证明NAC2通过MeSA介导AD对抗蚜虫
作者在研究中注意到,在NAC2叶子上定植的绿桃蚜虫数量比在WT叶子上的数量多得多,进一步研究了NAC2植株对蚜虫吸引力的作用。作者进行了圆形培养皿和Y管嗅觉仪生物测定,发现NAC2植株比WT植株吸引了更多的蚜虫,推测这可能是由空气传播信号介导的(扩展数据图1n-o)。作者使用气相色谱法与MS(GC-MS)相结合来鉴定蚜虫侵袭的WT植株与NAC2植株释放的挥发物。而MeSA是蚜虫侵袭WT植株与NAC2植株唯一产生差异的VOC,并且蚜虫侵染后WT释放的MeSA多于NAC2植株(扩展数据图2e-h)。MeSA是有据可查的可诱发蚜虫的VOC10-13主要挥发物。为了测试NAC2植株对蚜虫吸引力的影响是否归因于MeSA的挥发,研究人员使用GC-MS测量了对蚜虫侵袭的WT植株在空气中MeSA的排放率,发现每个蚜虫侵袭的WT植株MeSA的排放率为34ng h−1(相当于每天排放0.816µg)(扩展数据图2f)。此外,研究人员发现,含有0.8µg MeSA/羊毛脂处理的植株与蚜虫侵袭的WT植株有相似的MeSA排放(扩展数据图2i,j)。因此,研究人员使用0.8µg MeSA/羊毛脂涂抹对植株进行处理,结果表明NAC2和WT植株对蚜虫表现出相似的吸引力(扩展数据图1p,q)。然而,当单独用羊毛脂或羊毛脂与其他挥发物(如3,3-二甲基己烷)处理时,NAC2植株比WT植株对蚜虫更具吸引力(扩展数据图1r,s)。研究人员将NAC2和WT植株置于挥发性MeSA下24 h,然后通风2h,并比较了气态MeSA如何影响植株对蚜虫的吸引力。在这样的条件下,WT植株对蚜虫的驱避性更强(扩展数据图1t,u)。然而,在通风和不进行挥发性MeSA处理后,NAC2植株之间的蚜虫驱避性没有明显差异(扩展数据图1v,w)。此外,与未进行MeSA处理时观察到的情况一样,在MeSA处理下,与挥发性MeSA处理随后通风的WT植株相比,NAC2植株对蚜虫的吸引力仍然更大(扩展数据图 1x,y)。
为了解释这种现象背后的原因(扩展数据图1t-y),研究人员用挥发性MeSA处理NAC2或WT植株24 h,然后通风,量化接收植株(接收器)排放的挥发性MeSA。WT植株反而在空气中释放出更高水平的MeSA(图1a,b)。随后研究人员比较了蚜虫MeSA接收植株与模拟WT植株在涂抹后的吸引力,所有植株都含有MeSA/羊毛脂,但发现它们在蚜虫偏好方面没有差异(图1c,d)。此外,在用MeSA/羊毛脂涂抹NAC2和WT接收植株后,这些MeSA接收植株还同样吸引蚜虫(图1e,f)。接下来,研究人员以蚜虫侵袭的植物为发射植株(发生源),研究了NAC2植株在自然露天环境下AD的作用(图3a)。在被吸汁蚜虫感染后,WT植株不断排放VOC MeSA(图1g,h)。值得注意的是,NAC2接收植株释放的MeSA波动性较低,但是当发生源受到蚜虫攻击时,与WT接收植株相比,其表现出对蚜虫更高的吸引力(图1i-l)。与邻近的模拟发射植株相比,受蚜虫侵染的WT相邻接收植株对蚜虫的驱避性更强,而与模拟蚜虫攻击发射植株相邻的NAC2接收植株之间的蚜虫驱避性没有显著差异(图1m,n)。此外,在以接收植株喂食24小时后,WT中的蚜虫存活率降低,但NAC2接收植株的存活率没有降低(图 1o,p)。这些结果表明,一旦感知到MeSA,邻近接收植株中的MeSA生物合成是以NAC2依赖性方式调节进而介导可对抗蚜虫的AD。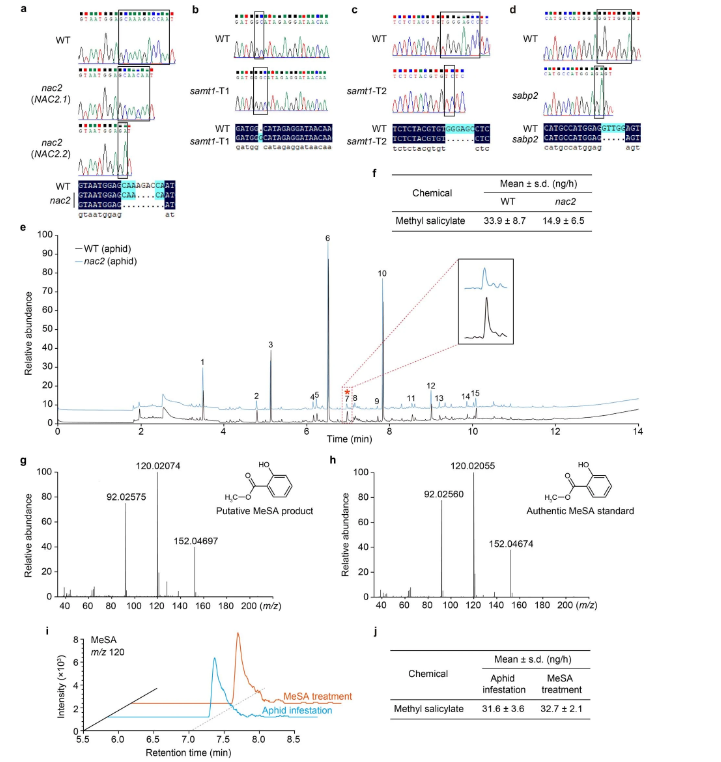
扩展数据图2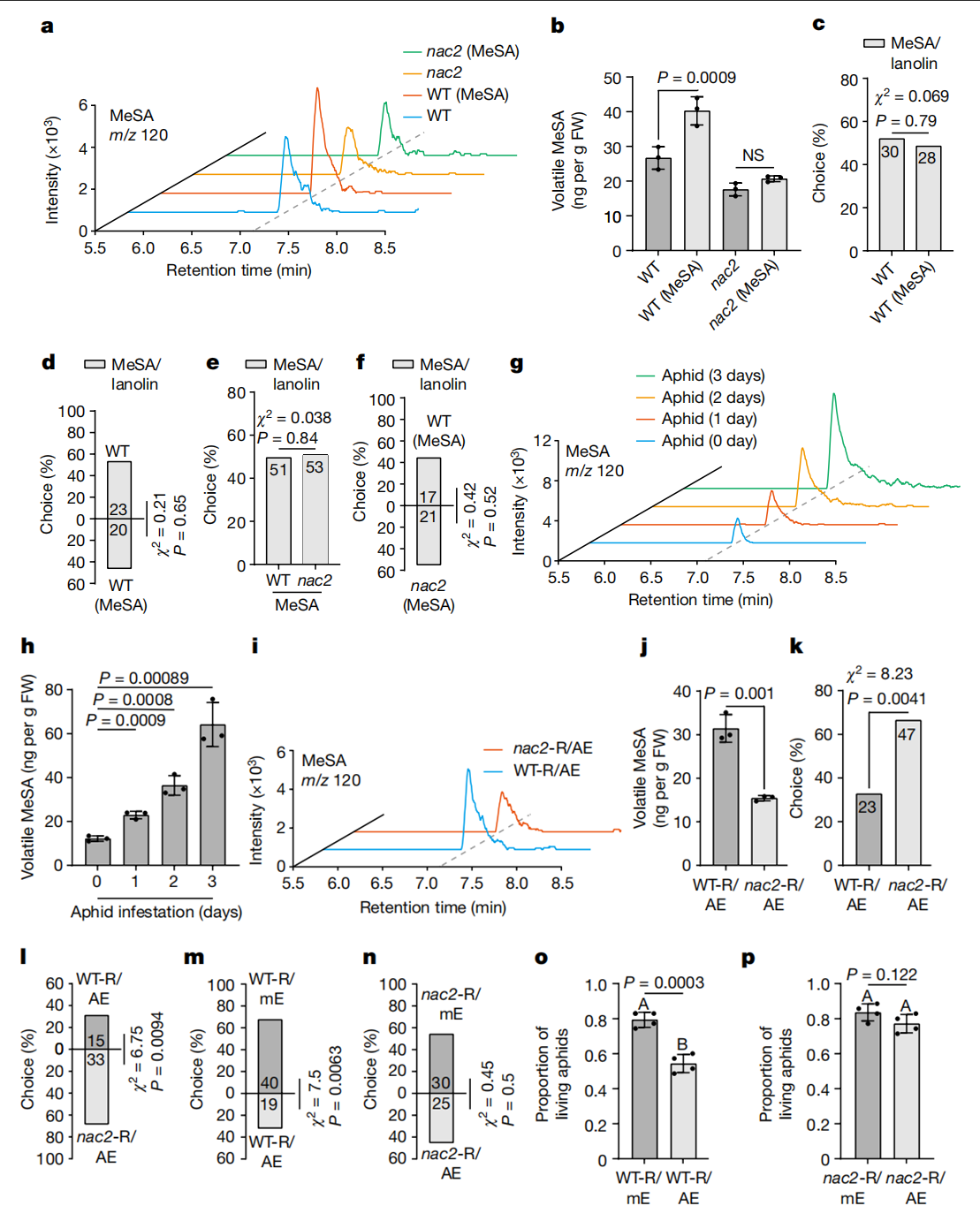
图1
3. NAC2激活SAMT1转录
接下来,研究人员开始探索NAC2和MeSA生物合成之间的分子遗传机制。NAC2作为转录因子(扩展数据图3b),可以定位于细胞核中(扩展数据图3c)。随后,研究人员对有和没有蚜虫喂食的WT和NAC2植株进行了RNA测序(RNA-seq)和比较转录组分析,并鉴定了许多潜在的NAC2调节差异表达基因(扩展数据图4和补充表1和2),其中SAMT1的结果特别令人感兴趣(扩展数据图4e)。无论这些植物是否受到蚜虫的侵袭,NAC2植株的SAMT1 RNA水平都低于WT植株(补充表1和2)。众所周知,SAMT1将SA转化为MeSA19,研究人员通过定量研究NAC2、HA-NAC2过表达和WT植株叶片组织中的SAMT1转录本,以评估NAC2是否通过调节SAMT1的转录表达。结果表明,与WT植株相比,NAC2植株的SAMT1 mRNA水平显著降低,但HA-NAC2过表达植株的SAMT1 mRNA水平升高(扩展数据图3d,e)。此外,荧光素酶报告基因实验表明,NAC2增强了SAMT1启动子控制下的报告基因的转录(扩展数据图3f)。ChIP–qPCR、酵母单杂交和EMSA分析均表明,NAC2与SAMT1启动子结合,并激活报告基因转录(扩展数据图3g-i)。此外,NAC2的瞬时过表达增加了植物MeSA的产生(扩展数据图 3j)。这些结果表明,NAC2-SAMT1模块与植物MeSA生物合成的调控有关。

扩展数据图3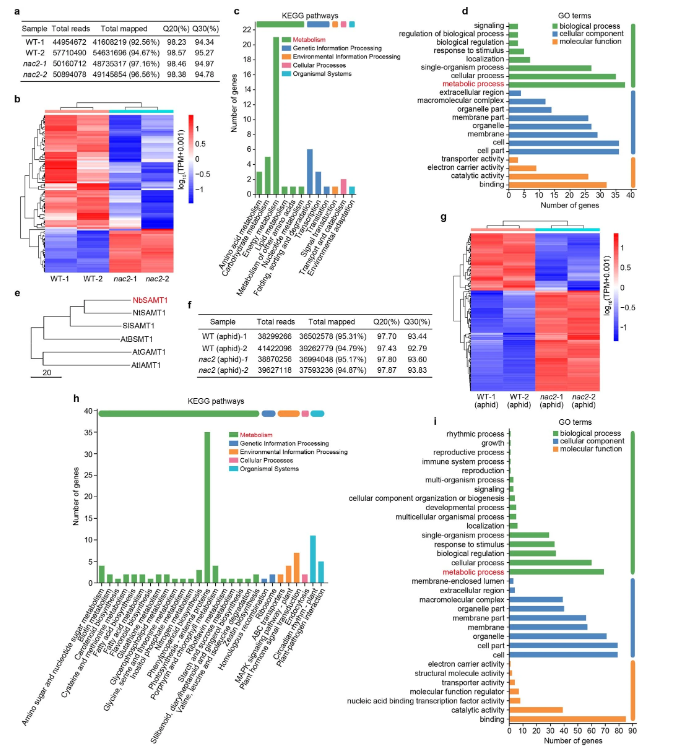
扩展数据图4
4. SA激活NAC2-SAMT1模块引发AD
为了研究NAC2是否通过激活SAMT1转录影响接收植株MeSA的产生,研究人员评估了不同处理条件下突变株NAC2、NahG和WT植株中的NAC2和SAMT1的mRNA水平(图 2f)。蚜虫侵袭后,WT和NAC2植株的SA水平升高程度相近,然而,细胞MeSA和SAMT表达的增加仅在WT植株中发现(图2e-g)。在WT接收植株和NAC2接收植株邻近蚜虫侵袭植株中也发现了类似的结果(图 2h-j)。这些结果表明,NAC2是蚜虫定向诱导或蚜虫介导的SAMT1表达和挥发性MeSA产生所必需的。此外,外源性SA上调了NAC2和SAMT1在WT植株中的表达,但在NAC2突变株中SAMT1 mRNA的表达水平未显著改变(图 2k,l)。与NAC2突变株相比,外源性SA也诱导WT植株的MeSA挥发性和蚜虫驱避性(图2m–p),并增加SAMT1-KO植株中NAC2和SAMT1转录本的水平(图 2q;图2b,c),samt1植株对蚜虫的吸引力也更强,而且在samt1植株中外源性SA不诱导蚜虫驱避(图2r-t)。此外,暴露于蚜虫侵袭的samt1植株中挥发性MeSA的产生减少(图3a,b),在进一步的蚜虫行为学实验中,研究人员发现与邻近模拟的WT接收植株相比,邻近蚜虫侵袭的WT发射植株的WT接收植株对蚜虫的驱避性更强,然而,无论何时将这些发射植株暴露于蚜虫侵袭中,与NAC2或SAMT1发射植株相邻的WT接收植株在蚜虫驱避性方面都没有显著差异(图3c-e)。这些结果进一步证实了MeSA作为植物AD中PPC信号的作用。总的来说,结果表明SA可以激活NAC2-SAMT1转录进而增加发射和接收植株中挥发性MeSA的产生。
作为一种SA结合蛋白,SABP2也可以与MeSA结合,这对于细胞内MeSA转化为SA至关重要。因此,SABP2可以作为一种OBP样受体,感知并将发射植株产生的挥发状态MeSA转化为SA以触发NAC2介导的接收植株中的蚜虫抗性。为了验证这一想法,研究人员首先确认SABP2与SA结合(图3f),通过竞争结合实验验证MeSA是否影响SABP2-SA的结合活性(图3g)。在无MeSA的情况下,SABP2-[3H]SA(50 Ci mmol−1)结合力为100%。然而,在相同的实验条件下,3nM和15nM的MeSA,SABP2对[3H]SA的结合活性分别降低到约74%和46%(图3g)。因此,3nM的MeSA足以满足用于[3H]SA与SABP2的竞争结合实验,表明MeSA可以以生理浓度与SABP2结合。随后,研究人员建立了SABP2-KO突变株(sabp2),并测试了sabp2突变株与WT植株的蚜虫驱避性,用挥发性的MeSA处理,然后进行通气,挥发性的MeSA处理可增加WT的蚜虫驱避性和SA生物合成,但对于sabp2突变株并没有增加(图3h-j和扩展图2d)。此外,蚜虫喂食WT发射植株增加了WT植株的蚜虫驱避性,但sabp2未增加(图3k)。此外,外源性的SA对WT和sabp2植株的MeSA挥发性无显著差异,表明SABP2对MeSA的释放不是必须的(图3l,m)。这些结果表明,SABP2确实是一种OBP样受体,可以感知并将空气中的MeSA转化为SA,引起NAC2介导的蚜虫驱避性。
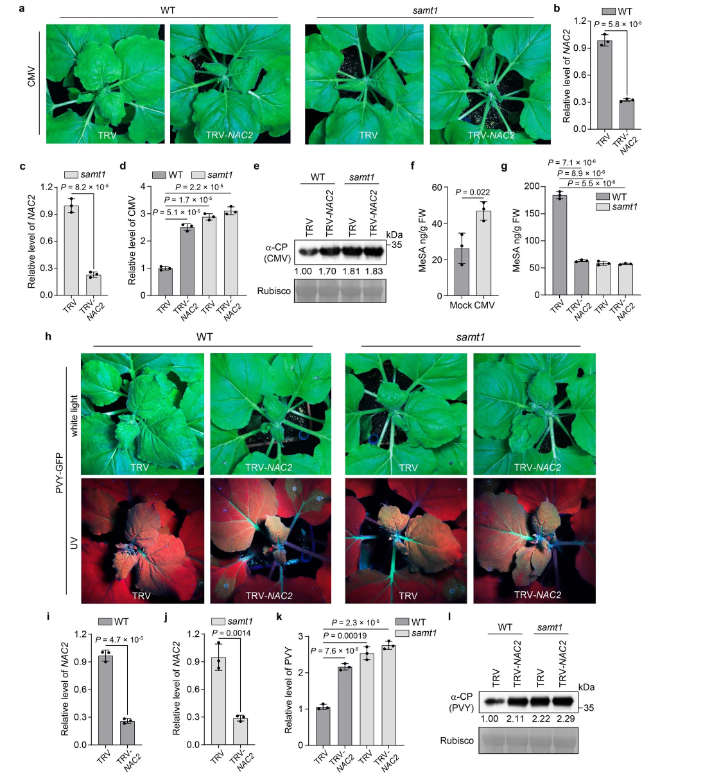
SAMT1是植物抗病毒免疫所必需的。为了测试SAMT1是否为NAC2介导的植物抗病毒免疫中的一个组成部分。研究人员敲低(KD)samt1植株中的NAC2,使用基于烟草脆裂病毒(TRV)诱导的基因沉默产生nac2/samt1双突变植株。与NAC2突变株一样,NAC2-KD植株表现出正常生长,和对CMV和PVY的高易感性(图1e-j,扩展数据图5a-e,h-l),表明病毒诱导的基因沉默NAC2-KD与NAC2-KO株有相似性。然而,nac2/samt1和samt1植株表现出相似程度的CMV或PVY易感性(图 5a-e,h-l)。此外,CMV感染增强了植物细胞内MeSA水平(扩展数据图5f)。在病毒感染期间,NAC2-KD、samt1和nac2/samt1植株的未侵袭叶片产生相似数量的MeSA,但与WT植株相比,数量较低(扩展数据图5g)。此外,作者还研究了外源性MeSA或SA在nac2、sabp2、samt1和WT不同植株中,MeSA是否以及如何通过NAC2介导植物抗病毒防御。与WT植株相比,nac2、samt1和sabp2植株对CMV和PVY更易感(图3n,o)。然而,外源性MeSA可以降低nac2和samt1植株的病毒易感性,但对sabp2植株无效(图 3n,o),可能是由于WT、nac2和samt1植株中的MeSA转化为 SA。外喷SA也可以降低nac2、samt1和sabp2植株的病毒易感性(图3n,o)。这与以下事实一致:SA可以抑制多种病毒对植物的感染,包括CMV、马铃薯病毒X和TMV。
综上所述,MeSA结合蛋白SABP2能够在结合MeSA时,将细胞间的MeSA转化成SA。由此实现信号的发起。随后SA激活NAC2-SAMT1模块,以此上调内源MeSA水平,促进NAC2依赖性SAMT1的转录与翻译。
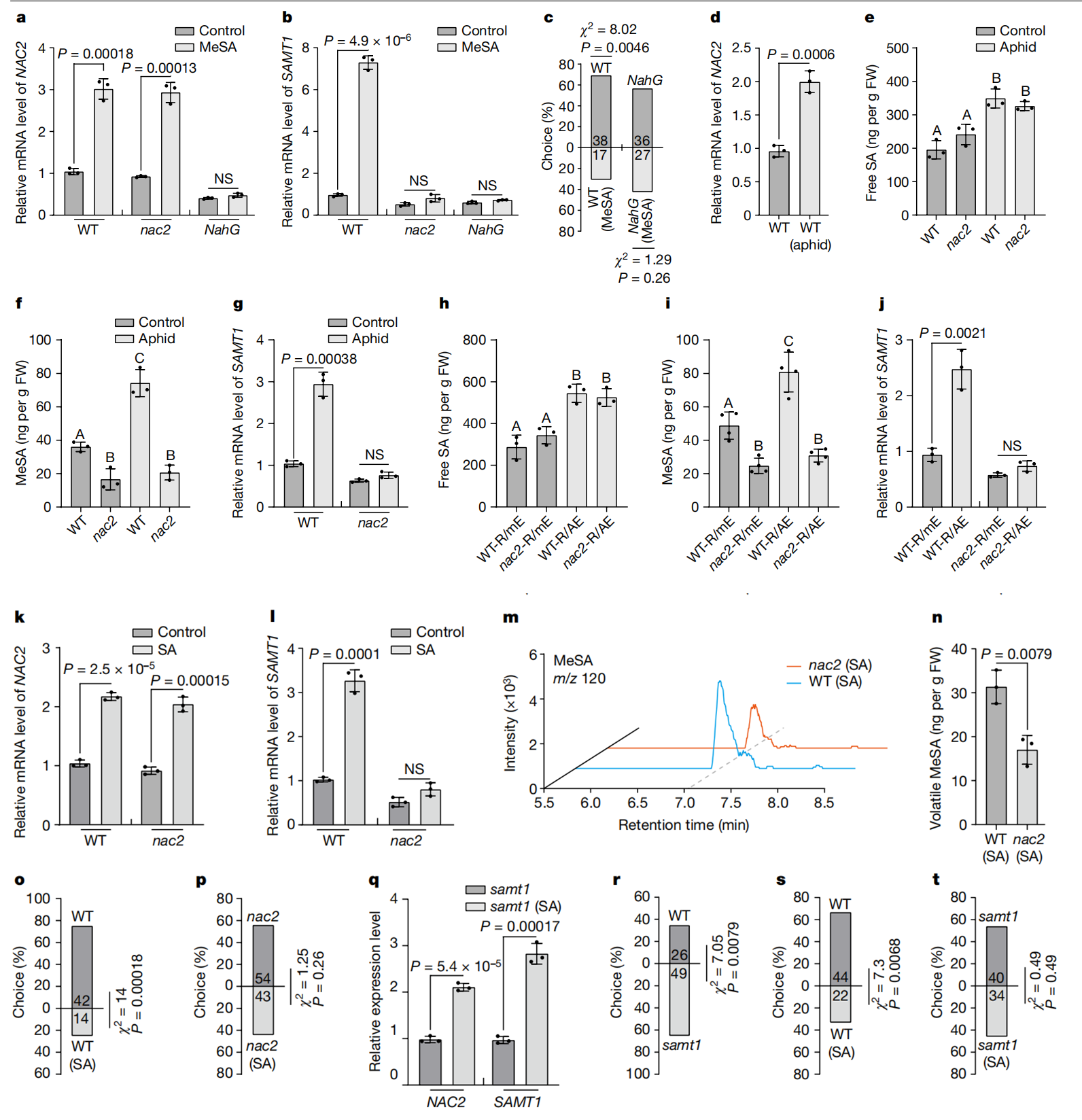
图2
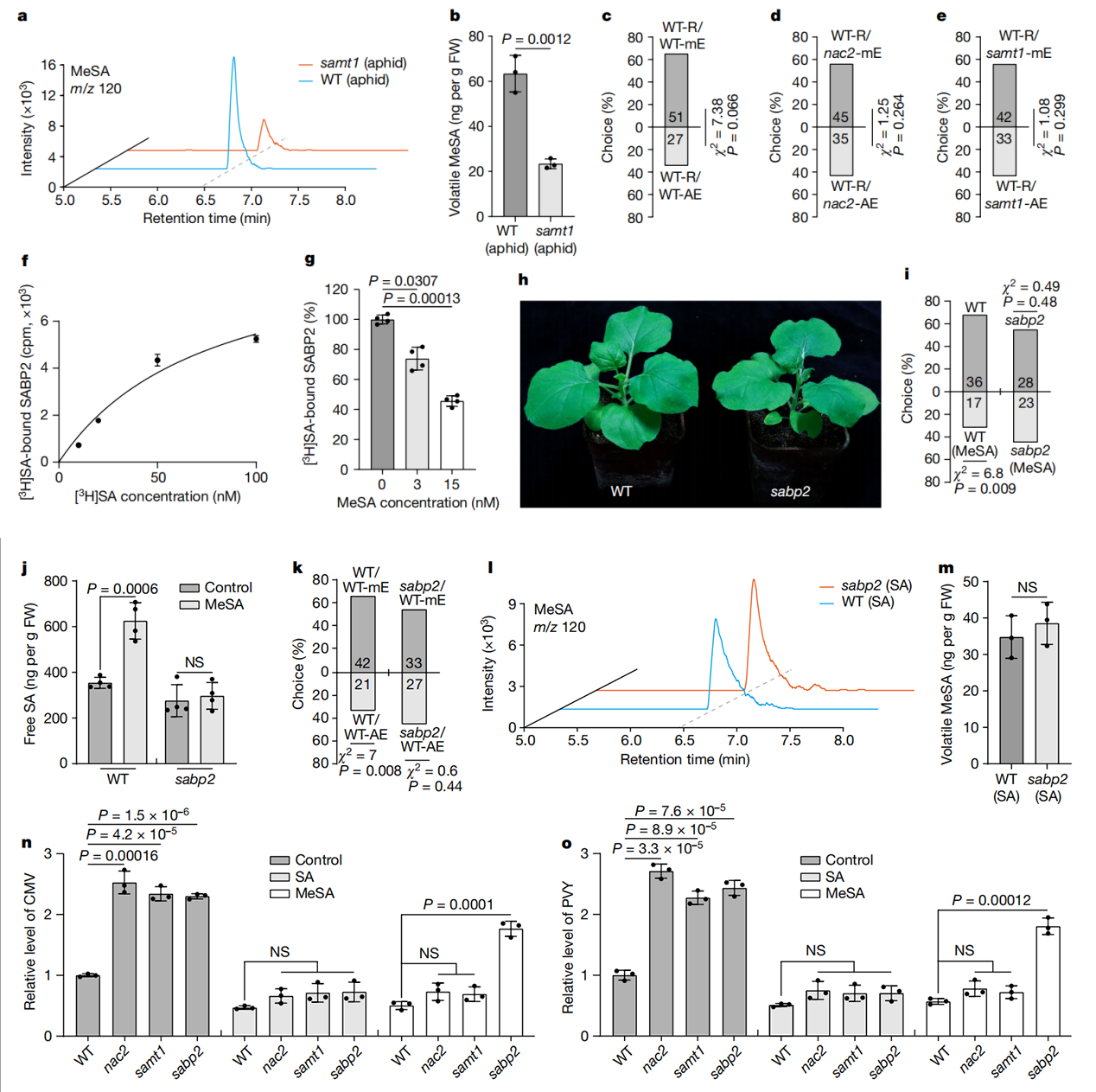
图3
扩展数据图5
5. CMV1a破坏NAC2的稳定性以抑制AD
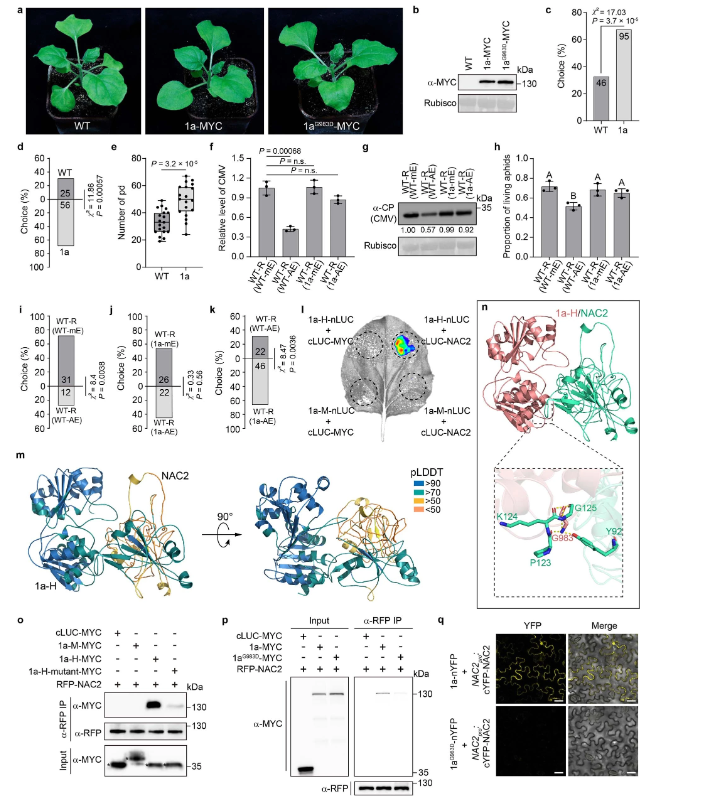
研究表明CMV感染可以抑制蚜虫诱导的AD(图4a),从而有利于蚜虫的生存和病毒的传播与感染,可能是通过CMV介导MeSA所致。CMV1a-NAC2相互作用(扩展数据图1a-d)表明CMV1a可能参与CMV介导的AD抑制。为了验证这一点,首先生成了表达CMV1a的转基因烟草植物(扩展数据图6a,b),并评估了CMV1a对植物、蚜虫和AD吸引力的影响。圆形培养皿和Y管嗅觉仪生物测定表明,CMV1a表达导致植物对蚜虫具有更高的吸引力(扩展数据图 6c,d)。表明CMV1a参与CMV介导的AD抑制。
为了了解 CMV1a-NAC2相互作用在CMV介导的AD抑制中的重要性,研究人员鉴定了CMV1a中与NAC2相互作用的关键氨基酸。CMV1a由N端甲基转移酶和C端ATP依赖性解旋酶结构域(HD)组成。此外,研究人员发现CMV1a HD是CMV1a-NAC2相互作用的主要区域(扩展数据图6l)。随后,研究人员使用Alpha Fold-Multimer27模拟了CMV1a-NAC2复合物的结构,并观察到 CMV1a中983位的甘氨酸残基与NAC2物理距离最近,预测该残基可能是CMV1a与NAC2相互作用所必需的(扩展数据图6m,n)。CMV1a HD或全长CMV1a中的G983D突变严重降低了CMV1a-NAC2的相互作用(扩展数据图 6o-q)。
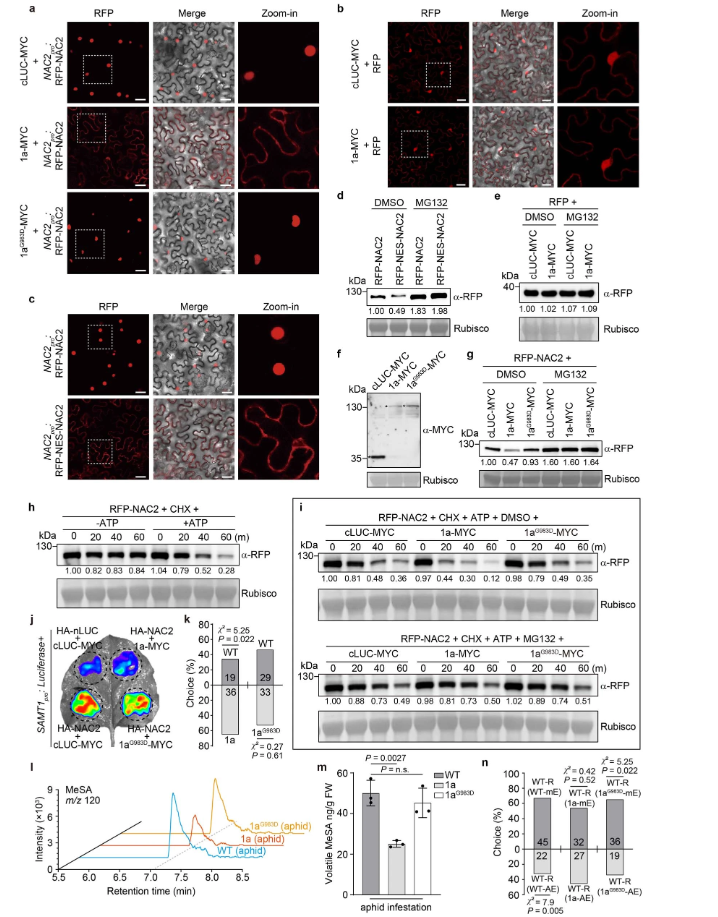
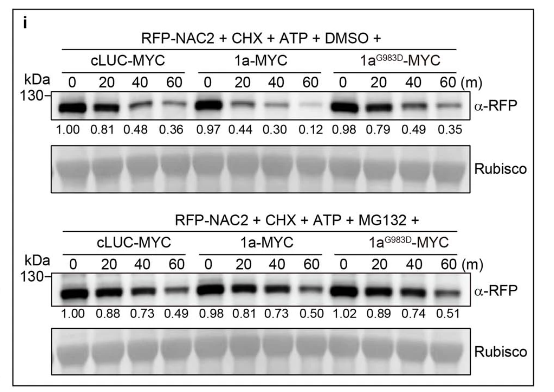
接下来,研究人员使用BiFC研究了CMV1a-NAC2相互作用的亚细胞定位,发现CMV1a在细胞核和细胞质中都与NAC2相互作用(图1c),这与没有CMV1a共表达的NAC2定位不同(图3c),表明CMV1a可以将一些NAC2从细胞核转移到细胞质。类似的还有CMV1a–MYC,但是cLUC–MYC和CMV1a(G983D)-MYC均未出现这种现象,这或许可以解释引起部分RFP-NAC2的细胞质定位和细胞核中较少的RFP荧光(扩展数据图 7a)。值得注意的是,CMV1a-MYC没有改变RFP核定位,表明CMV1a-MYC定向NAC2的重新定位取决于NAC2-CMV1a相互作用(扩展数据图7b)。此外,研究人员使用核输出信号(NES)标记的NAC2研究了细胞质NAC2的稳定性。结果发现NES-NAC2定位于细胞质中,NAC2易被26S-蛋白酶体系统降解(扩展数据图7c,d)。此外,瞬时CMV1a表达增强了26S-蛋白酶体系统对NAC2的降解,但不影响RFP稳定性(扩展数据图 7e-i),而CMV1a(G983D)未引起NAC2降解(扩展数据图7f–i)。
瞬时表达试验表明,是CMV1a而非CMV1a(G983D)抑制NAC2介导的SAMT1激活启动子(扩展数据图7j)。此外,CMV1a(G983D)或CMV1a植株与WT植株的Y管嗅觉仪生物测定和GC-MS分析表明,CMV1a(G983D)降低CMV1a介导的植物对蚜虫的吸引力和抑制MeSA挥发(扩展数据图7k-m)。而且Y管嗅觉仪生物测定提供了额外的证据,证实氨基酸残基Gly983对CMV1a抑制植株间AD至关重要。
综上所述,表明CMV1a通过与NAC2的直接相互作用,影响NAC2的亚细胞定位并破坏其稳定性,从而降低转录因子NAC2驱动的SAMT1激活和MeSA的产生,进而干扰和抑制AD。
扩展数据图6
扩展数据图7
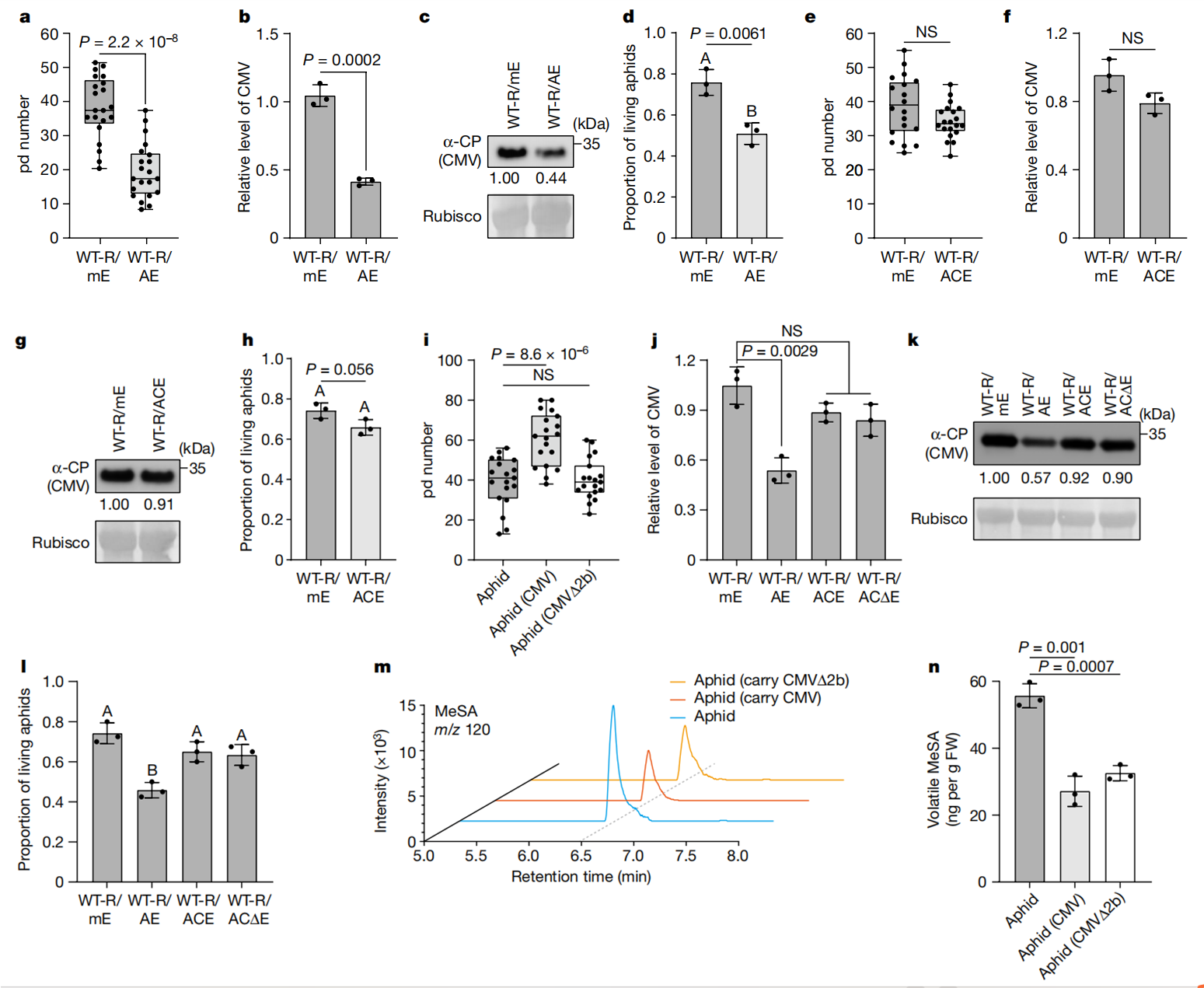
图4
6. 一些蚜虫传播的病毒抑制AD
CMV1a具有甲基转移酶和解旋酶活性,并构成病毒复制酶复合物的一部分,通过其HD与NAC2相互作用(扩展数据图1a-d)。值得注意的是,来自许多蚜虫传播病毒的HDs,包括马铃薯Y病毒、黄蜂病毒、黄体病毒和阿尔法莫病毒在与CMV1a Gly983相对应的位置均含有保守的甘氨酸残基(扩展数据图8和9a)。
GC-MS分析显示,PVY感染并影响了蚜虫侵染后植物MeSA的挥发。此外,作者还研究了,两种蚜虫传播的病毒CMV和PVY使NAC2能够从细胞核到细胞质重新定位(扩展数据图9i)。同样,PVY CI,而不是CI(G347D)或非蚜虫传播病毒TMV的126KD蛋白,与NAC2相互作用(扩展数据图9j,k),并部分破坏NAC2的稳定性(扩展数据图9l)。这些结果表明,一些蚜虫传播的病毒已经进化到利用含HD的蛋白质作为干扰植物AD的一般策略。
扩展数据图8 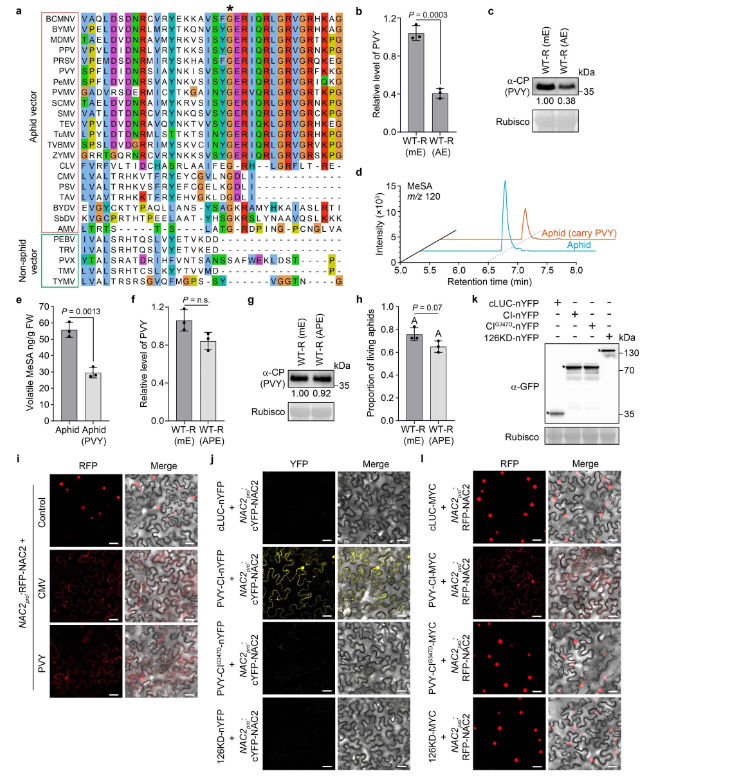
扩展数据图9
结论
索莱宝产品亮点


更多产品
|
套装货号 |
套装名称 |
描述 |
|
|
腺苷-5'-三磷酸 |
是体内能量储存和代谢的重要物质,为代谢提供能量,同时在细胞中作为辅酶发挥作用。 |
|
|
三磷酸腺苷二钠 |
是用于代谢反应中底物活化的磷酸基团供体和大量激酶的辅酶。 |
|
|
腺苷-5'- 单磷酸一水 |
是腺苷A1受体(adenosine A1 receptor)激动剂。 |
|
|
6-苄氨基喋呤 (6-BA) |
是一种细胞分裂素,通过刺激细胞分裂引起植物生长和发育,可调节植物的抗氧化系统的活性。 |
|
|
24- 表油菜素内酯 |
是一种植物生长激素。据报道,具有缓解植物重金属和农药胁迫潜力。此外,在各种癌细胞中是一种潜在的凋亡诱导剂,而不影响非肿瘤细胞生长。 |
|
|
28- 高油菜素内酯 |
是一种具有生物活性的化合物。 |
|
|
28- 表高油菜素内酯 |
具有高促生长和抗应激活性的一类新型甾体植物激素。 |
|
|
1-萘乙酸(NAA) |
是具有生长素活性的合成植物生长调节剂。 |
|
|
3-吲哚乙酸 |
是一种植物生长激素。可以添加到细胞培养基中用来诱导植物细胞伸长和分裂。 |
|
|
吲哚丁酸 |
是植物生长素和良好的生根剂。它可以促进草本植物和木本观赏植物生根,并用于提高果实率。 |
|
|
吲哚丙酸 |
是一种有效的神经保护性抗氧化剂和植物生长素。 |
|
|
吲哚乙腈 |
是一种植物生长激素。 |
