血管负责输送氧气和营养物质,并参与调节炎症、清理代谢废物等,对人体几乎所有组织都至关重要。因此,体外重建功能性血管网络是基础研究和转化应用的基础。而功能性血管网络生成的关键挑战在于内皮细胞 (EC)和血管壁细胞 (MC,包括周细胞和平滑肌细胞) 的协同分化。这两种细胞依赖于紧密关联的信号通路(包括 PDGFB、Notch 和 TGFβ),但所需的培养条件各不相同且通常互不兼容,因此共分化极为困难。
直接分离原代细胞存在重重阻碍,包括技术难度大、组织来源受限、扩增与稳定性较差等,且为伦理和临床所限制。诱导多能干细胞(iPSCs)提供的可扩展的、自体来源的血管细胞或许是一种替代方案,但其依旧存在成熟度不足的问题,限制了在体内植入后的存活和功能发挥。最近的研究虽然引入了血管类器官(VOs)的概念,但这些类器官仍然依赖于MCs的自发分化,缺乏对细胞组成的精细调控,且在治疗应用方面存在诸多不足,例如需要培养周期长(约3周)且缺乏可扩展性等。
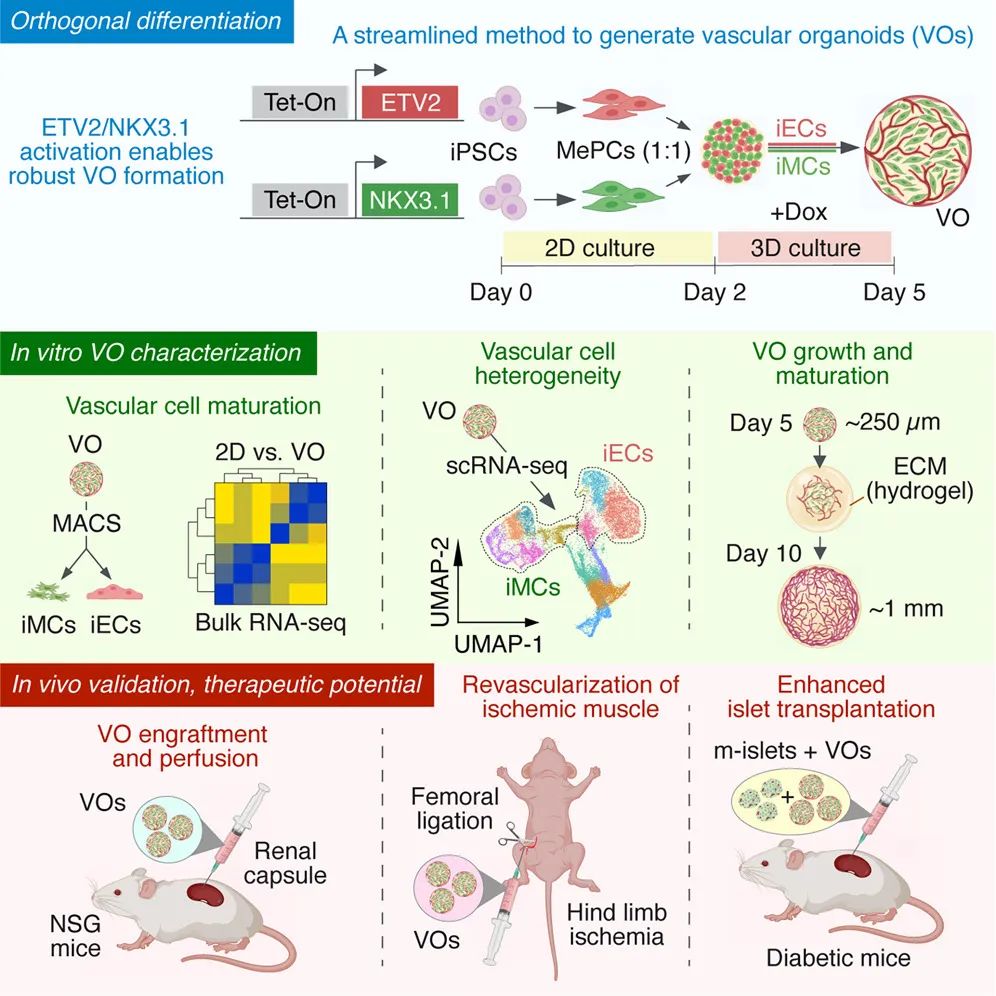
2025年6月13日,哈佛大学医学院联合波士顿儿童医院及北京大学等单位,在期刊Cell Stem Cell发表论文“Rapid generation of functional vascular organoids via simultaneous transcription factor activation of endothelial and mural lineages”,开发了一种基于hiPSC的快速且明确血管类器官构建方案。通过精确激活两种转录因子ETV2和NKX3.1,同时驱动了内皮细胞和壁细胞的形成,仅需5天便获得了自组装的功能性血管。基质胶等ECM的嵌入推动了血管网络的进一步成熟和动脉化。移植小鼠后可重建血管并执行血液灌注等生理功能,有助于提高胰岛移植的成功率和功能恢复,具有协助治疗糖尿病等疾病的临床价值。

该方法首次实现了对构建功能性血管所需的两种主要血管细胞类型的完全、独立控制,从而为血管网络建模、组织工程和再生医学提供了一个强大的新平台。
01 双谱系转录激活
为了实现对ECs和MCs的共同分化,研究团队首先利用基因工程手段对hiPSC细胞系进行了改造,使其能够在分化为中胚层祖细胞后,于多西环素(Dox)诱导条件下分别表达ECs和MCs发育过程中的关键转录因子ETV2和NKX3.1。结果仅需短短5天(传统方案用时3-4周甚至更久),研究团队即获得了数千个均匀大小的血管类器官(VOs),平均直径约为250 μm。
中胚层标记物TBXT和MIXL1在Dox处理后逐渐下降,表明功能性分化的成功诱导。在Dox处理3天后(培养第5天),约50%的细胞分化为iECs(iPS生成的ECs),且观察到了CD31+血管网络的生成。与此同时,iMCs标志物ACTA2和MYH11的检出也表明,该类器官同时分化出了周细胞,并具有平滑肌细胞的特征。
从结构上看,MCs已经正确地定位在ECs周围,形成的典型的血管结构显示出早期的管腔形成迹象,虽然尚未开放或灌注,但其结构与新生血管一致,表现出正确的顶底极性。
将VOs移植小鼠肾包膜下,观察到数周的稳定保持,iEC无明显损失。到第14天,观察到高度血管化的移植物的形成,组织学也显示广泛的灌注血管网络,表明VOs在移植后保留了功能性。
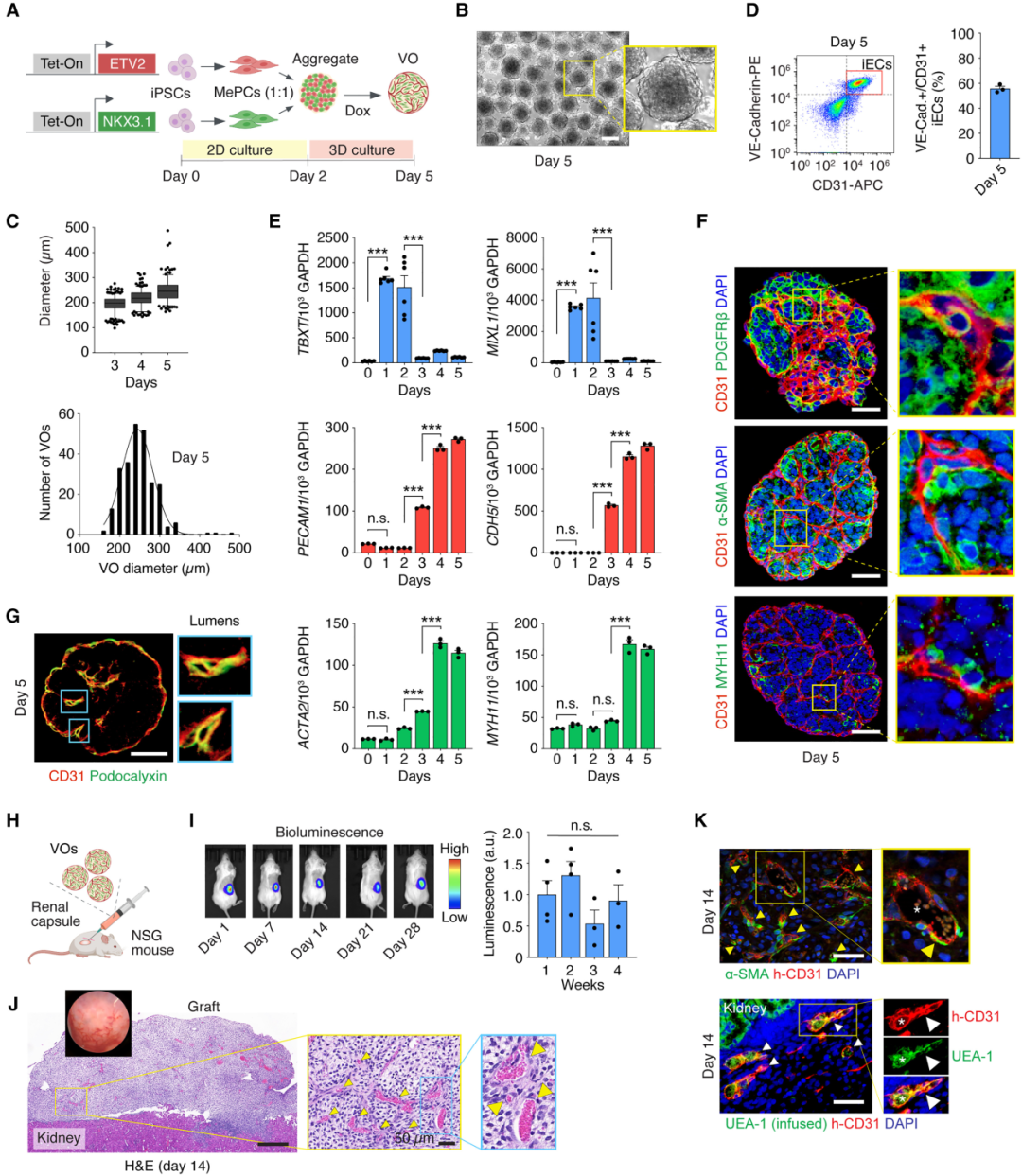
图:通过ETV2和NKX3.1激活生成和体内植入血管类器官
综上所述,这种双TF驱动的VO方法不仅促进了iECs和iMCs的正交分化,还促进了细胞间相互作用,从而在短期内快速形成了具有空间组织的血管网络,移植体内时具有血液灌注等生理功能。
共分化促进了VOs的成熟
与化学诱导的VO生成方案相比,基于TF的VO中ECs比例更高(约2%),MCs更为成熟。这可能是由于TF激活后EC和MC在类器官内实现了有效的共培养。
具体而言,研究人员通过GO分析发现,iECs中,脉管系统发育、血管生成、血管生成和平滑肌细胞(SMC) 增殖等相关基因上调。同样,iMCs显示除与成熟间充质和壁功能相关的基因富集,包括间充质发育、分支形态发生和动脉发育等,TGF-β 、BMP 信号转导和血管生成调节因子(FGF2 和 ANGPT2)的标志物也有显著上调。总之,EC和MC的共同分化通过多个信号通路促进了血管网络的发育。
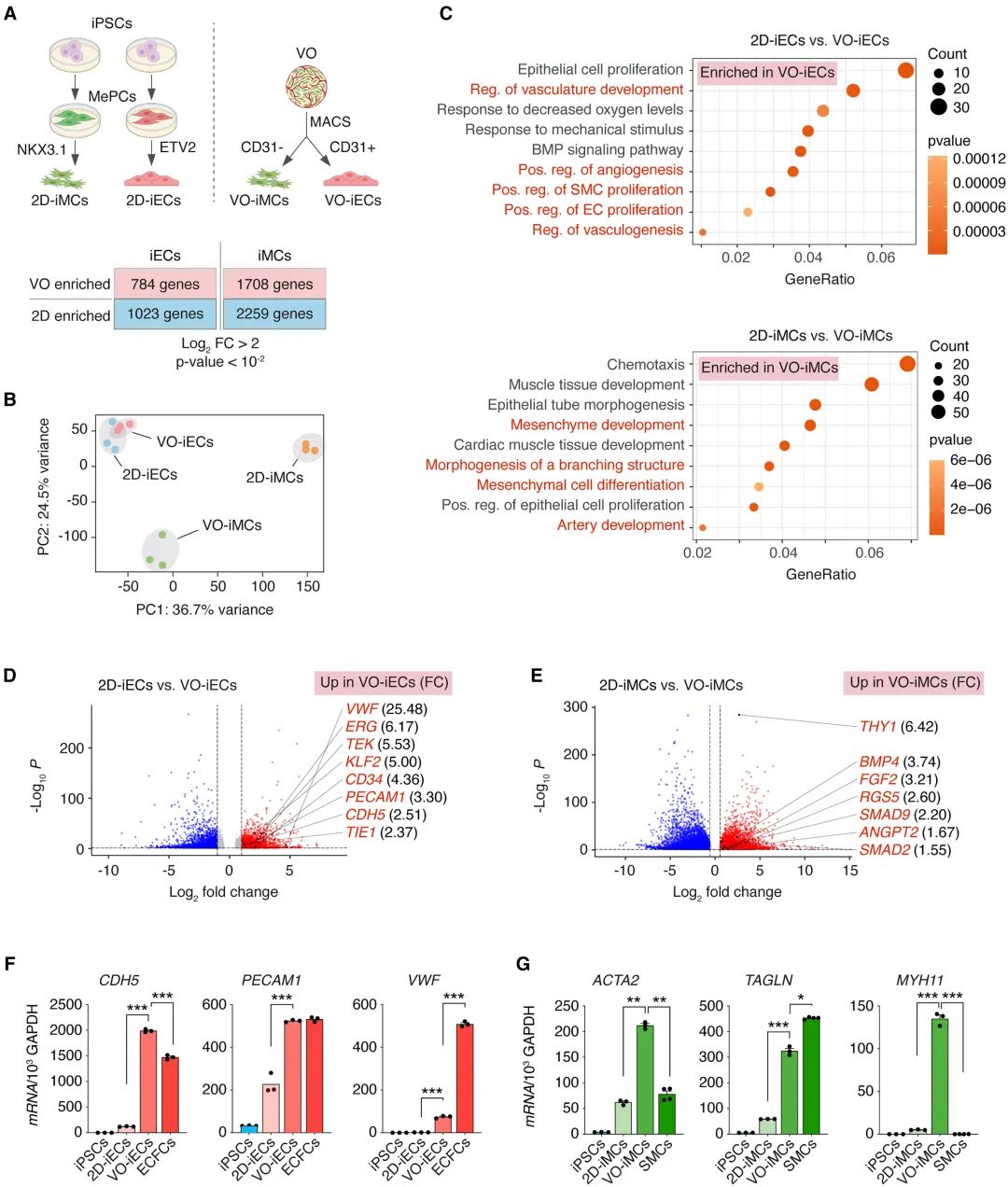
图:共表达ETV2和NKX3.1促进iEC和iMC成熟
VO具有血管细胞异质性
最后,研究团队使用scRNA-seq证明,生成的VO成功捕获了跨iEC和iMC谱系的血管细胞异质性。
需要注意的是,较短的激活时间倾向于产生动脉样内皮细胞,而较长的激活时间则产生更异质的内皮细胞群体,包括具有更强血管生成潜力的静脉样细胞,有助于血管类器官的进一步成熟。这对于调控血管类器官的发育和功能具有重要的指导意义。
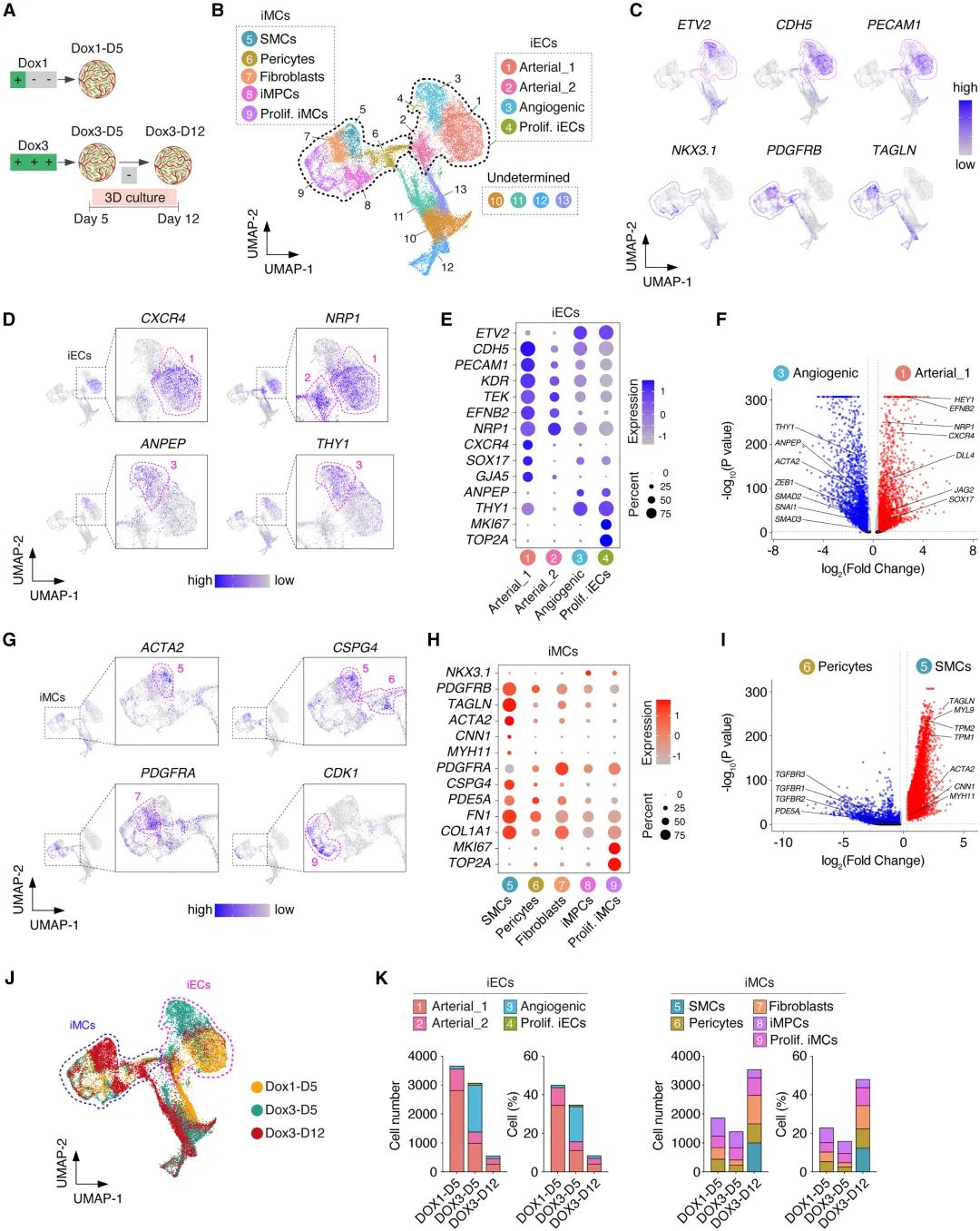
图:VO内的内皮和MC的异质性
02 ECM包埋促进血管网络成熟
在血管发育中,细胞外基质(ECM)不仅能为EC提供物理支撑,使其能够在三维空间中正确组织,还以高度动态的信号调控途径参与血管形态发生的调控。因此,接下来研究人员进一步探索了外源ECM添加对VOs的影响。
结果发现,将上述实验获得的VOs在胶原蛋白或基质胶等ECM中继续培养5天(不继续Dox诱导),可产生更为成熟的 VO (mVO)。基质胶的包埋显著促进了血管发育,使得生成的血管网络更大、更复杂,直径更是从最初的250 μm迅速扩大至近1000 μm。且检测到致密CD31+脉管系统与明显的管腔,表明内皮细胞已经成功形成了复杂的血管结构,类似于体内的功能性血管。
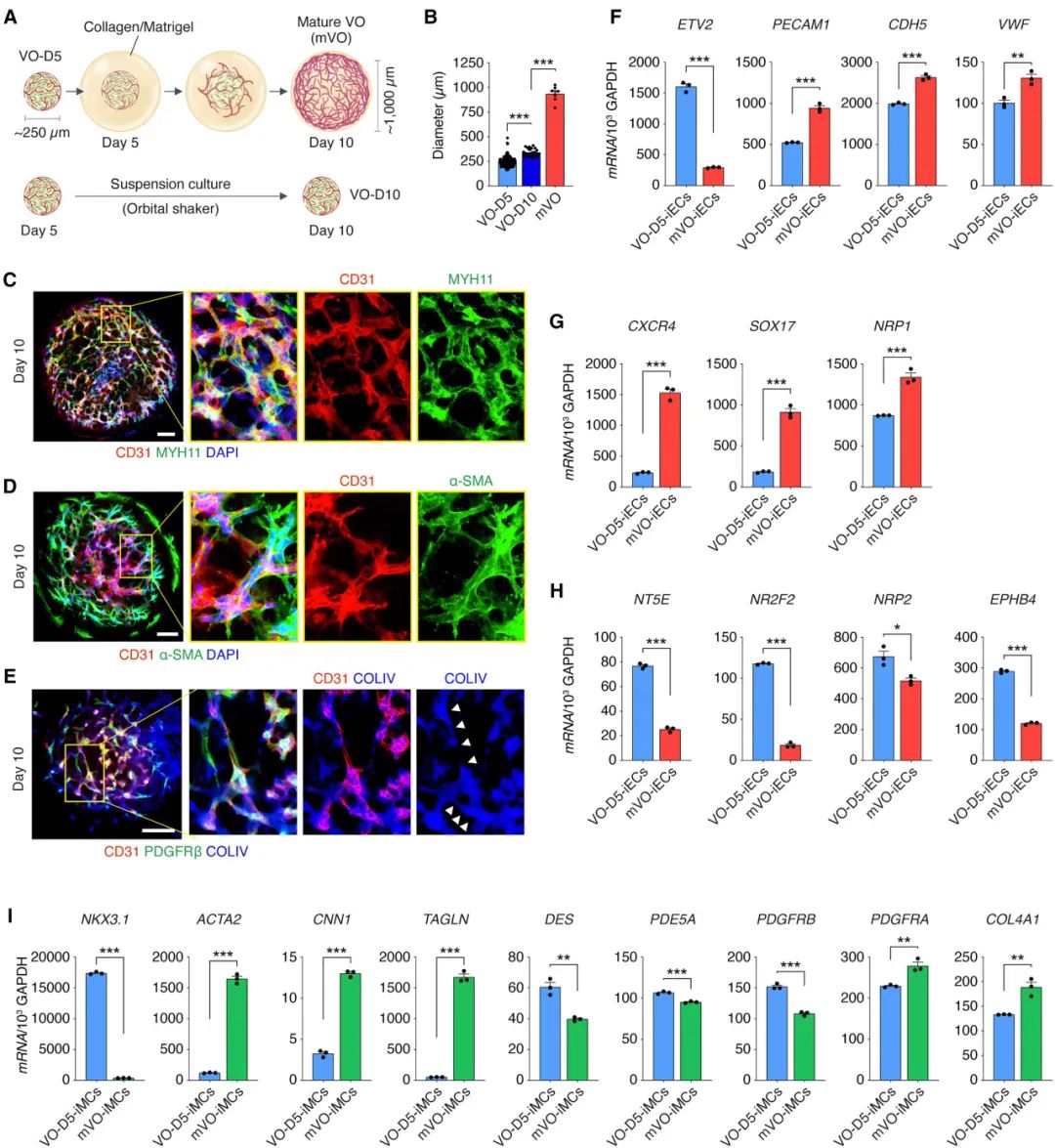
图:嵌入基质胶有助于VO的成熟
qPCR结果显示,相较于未嵌入ECM的VO-iECs,mVO中内皮标志物及动脉标志物均有显著上调,同时静脉标志物表达下调,表明其向动脉样身份转变,伴随着更广泛的内皮成熟。mVO-iMC中,平滑肌细胞标志物表达增加,周细胞标志物表达则有所下降,符合生理条件下血管成熟中的演变,进一步支持了血管成熟和动脉化。后续实验还强调,该结果仅归因于ECM的包埋,而与培养时间的延长无关。
以上结果表明,嵌入ECM有助于VOs形成更为成熟、组织程度更高的血管网络。这种成熟包括 iECs 的动脉化和跨血管细胞类型谱系特异性基因的上调,使 VOs 在转录上更接近原代细胞,并强调了它们的生理相关性。
03 无基因工程的VO培养方案
接下来,研究团队试图用化学修饰的mRNA(modRNA)替代基因工程手段,通过瞬时转染而非长期诱导激活ETV2和NKX3.1的表达。
他们从未修饰的iPSC开始,首先在2天内将其诱导分化为中间体MePC,随后分别用编码ETV2和NKX3.1的modRNA各自转染一半MePC,再以1:1的比例混合并摇床培养2天。
同样在5天内,研究团队获得了大小均匀的VO(MODRNA-VO),其大小与Dox诱导型VO相当,但第5天的iEC比例(20%-30%)比Dox-VOs(约55%)更低。这可能是因为Dox允许持续激活,而modRNA只会产生短暂(约24小时)的表达。如前所述,缩短转录因子激活时间倾向于产生主要为动脉样的iECs,而延长激活时间则产生了具有更强血管生成潜力和更高移植后整合能力的异质性iEC群体。
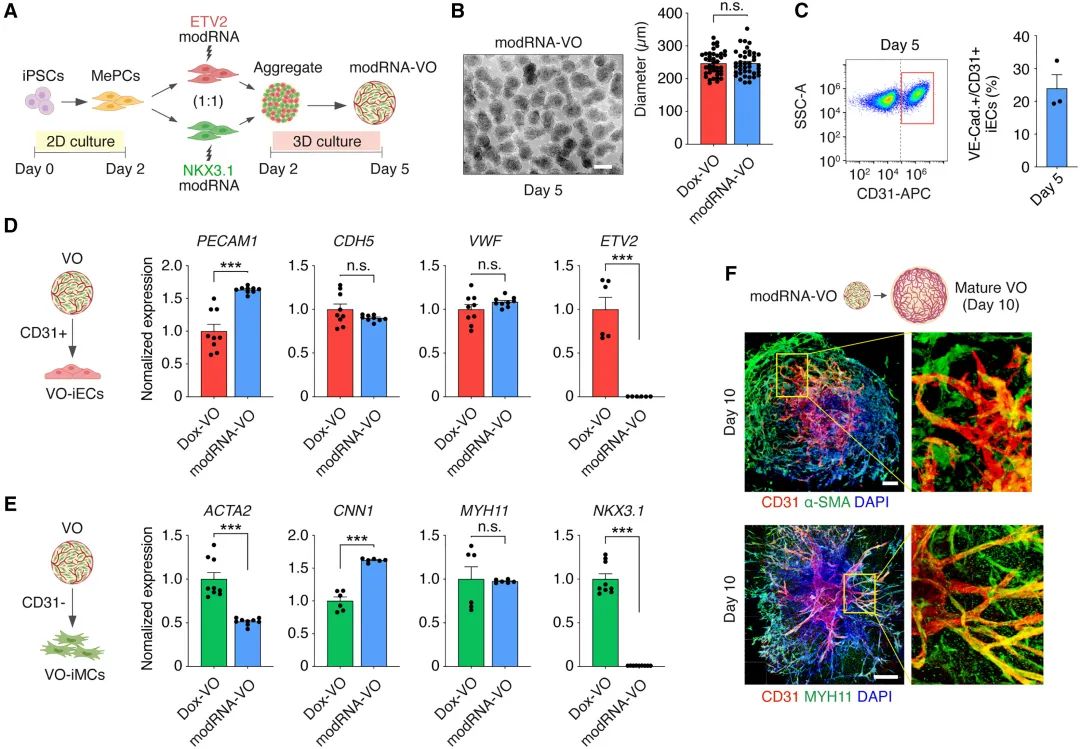
图:Dox诱导和modRNA介导的VO生成的比较分析
尽管如此,modRNA-VOs中的血管细胞成熟并未受损,这从iECs和iMCs中关键内皮和周细胞标记物的表达中可以看出。此外,与Dox-VOs类似,嵌入胶原蛋白或水凝胶也显著促进了modRNA-VOs的血管成熟程度。
04 VO的体内治疗潜力
胰岛移植是一种治疗1型糖尿病(T1DM)和某些2型糖尿病(T2DM)患者的手术方法,其基本原理是从供体胰腺中分离出能够产生胰岛素的胰岛细胞,并将其移植到患者的体内,以恢复内源性胰岛素的生成,从而实现血糖控制。
不过,移植后的胰岛细胞在早期阶段容易受到缺血损伤。血管的植入可以迅速恢复血液供应,减少缺血时间,从而提高胰岛细胞的存活率。此外,血管类器官还为移植的胰岛细胞提供足够的营养物质,并帮助改善抑制后的微环境、提高移植效果、减少并发症等。
考虑到以上临床应用场景,研究人员最后在糖尿病免疫缺陷裸鼠的后肢缺血模型中测试了VOs的治疗潜力。结果表明,VOs能够有效地植入,恢复灌注,并预防坏死。在胰岛移植模型中,研究人员发现与VOs共移植增强了胰岛的功能植入,通过促进血管再生,使得使用较少的胰岛数量就能有效地逆转小鼠的糖尿病。
总之,VO在移植小鼠模型后能够促进强劲的血管重建,从而显著提高胰岛移植的成功率和功能恢复,有效逆转糖尿病,具有极高的临床应用潜力。
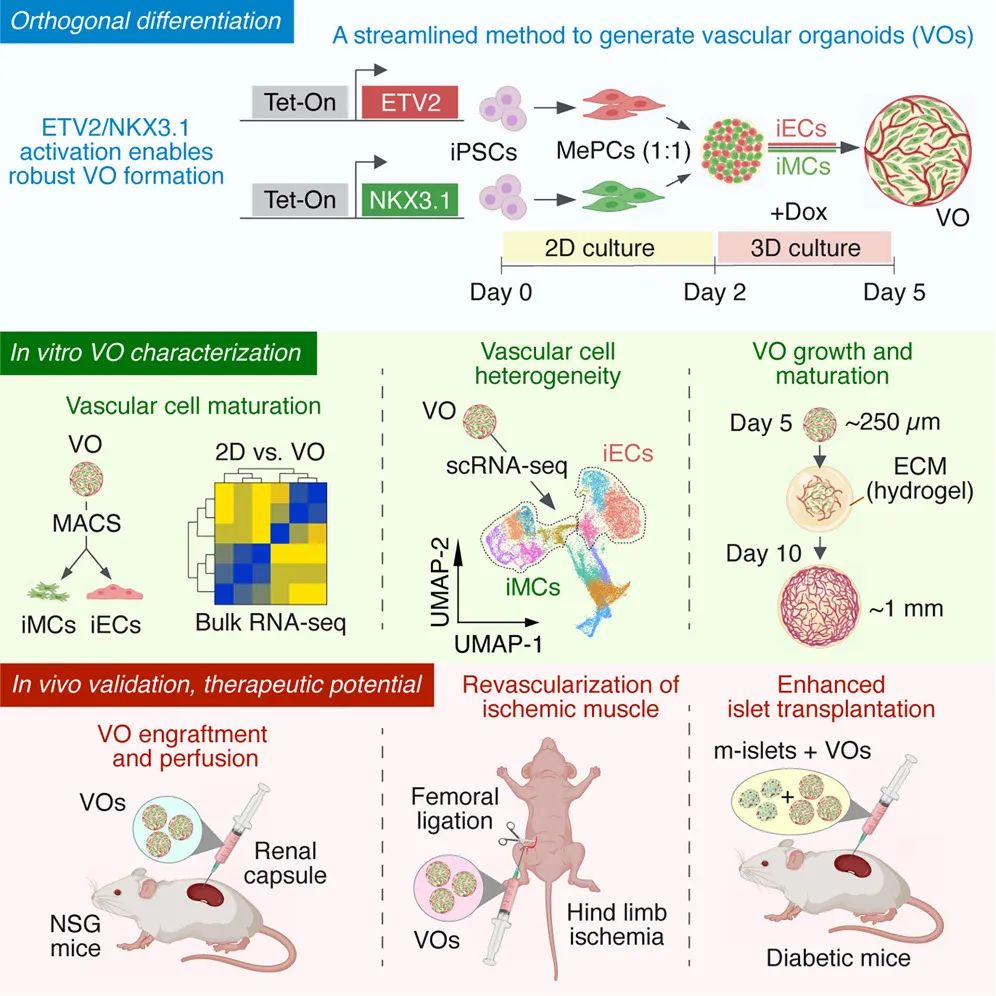
图:VO的体内治疗潜力
05 总结
本文提出的双TF激活方案代表着一项重大进展。通过快速生产具有可控双谱系特征的自组装、功能性血管类器官,该系统为血管疾病建模、疗法测试和组织工程提供了一个可扩展的平台。尤其在嵌入ECM后,更表现出向动脉样身份的进一步转变。该方案为血管类器官研究的速度和复杂性树立了新的标杆,并为未来的再生医学应用带来了希望。
不过,作者也提到,由于两种转录因子均由相同的Dox触发因子诱导,因此对EC和MC发育的独立调控仍然受限。未来宜使用正交诱导系统(例如结合Dox和modRNA)进行改进,以期实现更灵活的调控。此外,目前的悬浮培养也缺乏灌注,限制了模拟剪切应力的能力,而剪切应力是内皮成熟的关键调节因子。将 VO 整合到可灌注平台中可能会增强生理相关性。最后,iPSC 衍生的内皮细胞能否在植入后获得组织特异性身份也有待进一步研究。
近岸蛋白相关产品
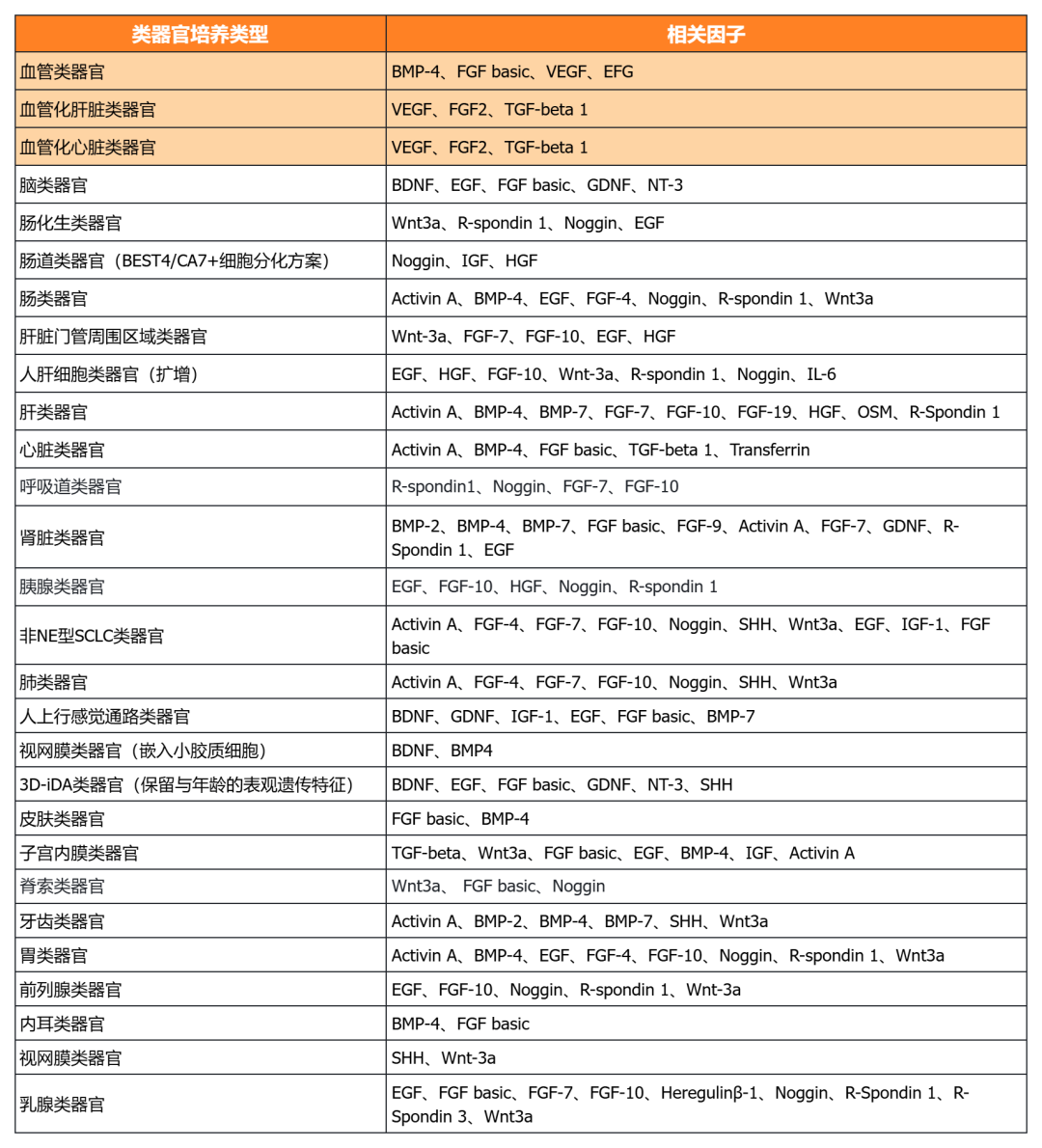
近岸蛋白提供多种类器官体外培养全方案,包括基质胶、培养基、相关细胞因子等:
经类器官培养验证的完全培养基
经类器官培养验证的细胞因子
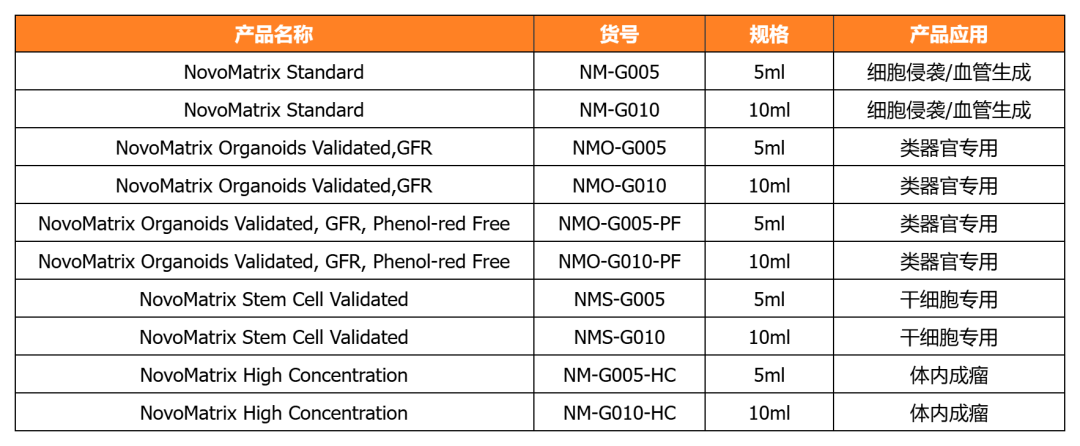
NovoMatrix基质胶
参考资料
Gong L, Zhang Y, Zhu Y, et al. Rapid generation of functional vascular organoids via simultaneous transcription factor activation of endothelial and mural lineages. Cell Stem Cell. Published online June 10, 2025. doi:10.1016/j.stem.2025.05.014
