
因细菌和真菌感染,器官产生的免疫细胞积累被称为肉芽肿。肉芽肿有助于控制感染,但也会引起疾病。最近的研究表明,免疫细胞和结构细胞之间的相互作用网络有助于维持肉芽肿,但肉芽肿的形成的分子和细胞过程尚不清楚。
2023年2月,奥地利科学院分子医学研究中心的Krausgruber团队在Immunity (IF 43.474)杂志上发表题为“Single-cell and spatial transcriptomics reveal aberrant lymphoid developmental programs driving granuloma formation”的研究,通过对12名持续性皮肤结节病患者的配对样本,利用单细胞转录组测序、空间转录组联合的方式,对肉芽肿的分子和细胞结构进行分析,确定了肉芽肿与淋巴器官发育相关的转录进程,探究了个体和器官之间共享的肉芽肿病理机制,为治疗干预肉芽肿提供了潜在的靶点。

研究材料
持续性皮肤结节病患者的病变皮肤和非病变皮肤,n=12技术路线
步骤1:单细胞转录组和空间转录组分析皮肤肉芽肿的细胞类型;
步骤2:细胞表达谱构建及关键免疫细胞类型锁定;
步骤3:巨噬细胞的亚聚类及肉芽肿相关巨噬细胞的定位;
步骤4:T细胞的多重亚聚类及关键免疫特征;
步骤5:成纤维细胞的亚聚类及免疫表达分析;
步骤6:细胞互作分析及免疫荧光验证;
步骤7:三级淋巴结构(TLS)特征分析及小鼠模型验证。
研究结果
1. 巨噬细胞、T 细胞和成纤维细胞是皮肤肉芽肿的主要细胞类型
作者对12名持续性皮肤结节病患者的病变和非病变皮肤的配对活检组织进行了单细胞转录组测序,共得到56000个单细胞,并鉴定到淋巴细胞、骨髓细胞、角质形成细胞、肥大细胞、成纤维细胞、内皮细胞、周细胞和黑色素细胞8个细胞类型。接下来,对12名患者的皮肤活检组织进行了空间转录组学和免疫荧光蛋白染色。单细胞数据可通过反卷积映射在空间转录组的分布上。免疫荧光蛋白染色将CD3+ T细胞,CD68+巨噬细胞和CD90+成纤维细胞鉴定为肉芽肿内的主要细胞类型。总之,这些单细胞和空间图谱使我们能够使用综合生物信息学方法系统地研究结节病肉芽肿中的主要细胞类型及其相互作用。
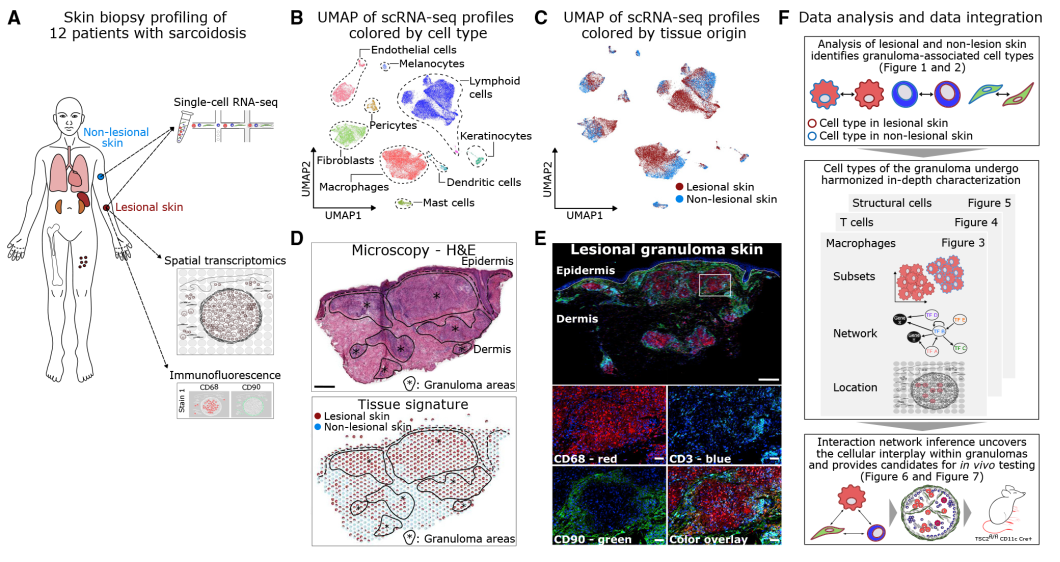
图1 12例皮肤结节病患者配对样本的单细胞/空间转录组测序及肉芽肿细胞空间定位
2. 特定的巨噬细胞、T细胞和成纤维细胞亚群在肉芽肿中积累
作者根据转录相似性聚类了20个细胞簇,并根据标记基因的表达进行细胞定义。在病变和非病变皮肤中观察到7个非免疫细胞簇(主要是结构细胞)和13个免疫细胞簇。结构细胞包括血液内皮细胞,淋巴内皮细胞,成纤维细胞等;免疫细胞包括树突状细胞,细胞毒性T细胞,辅助性T细胞,调节性T细胞,自然杀伤细胞,B细胞,巨噬细胞和肥大细胞。来自簇0(病变巨噬细胞)、簇1(病变辅助性T细胞)和簇9(病变成纤维细胞)的细胞几乎只存在于病变皮肤中。相比之下,内皮细胞,上皮细胞,黑色素细胞,肥大细胞,树突状细胞和某些淋巴细胞亚群没有这种分布差异。
作者对空间转录组学数据进行了UMAP降维和无监督聚类,产生了四个簇。簇0、1和2在所有样本中均存在,而簇3仅存在于包含血管组织的样本,主要是平滑肌细胞。作者在组织学上将这些簇注释为肉芽肿性真皮(簇0)、未受影响的真皮(簇1)和表皮(簇2)。细胞反卷积显示,巨噬细胞、辅助性T细胞和成纤维细胞的病变亚群主要存在于肉芽肿性真皮(簇0)中,而非病变亚群存在于未受影响的病变组织(簇1)中。作者进一步将皮肤肉芽肿的数据与已发表的肺肉芽肿、眼眶脂肪组织、泪腺组织和进行性纤维化肺肉芽肿组织的bulk RNA-seq数据进行了比较,这些肉芽肿的基因特征在病变皮肤中始终富集,表明肉芽肿形成的某些调节途径在器官之间共享。
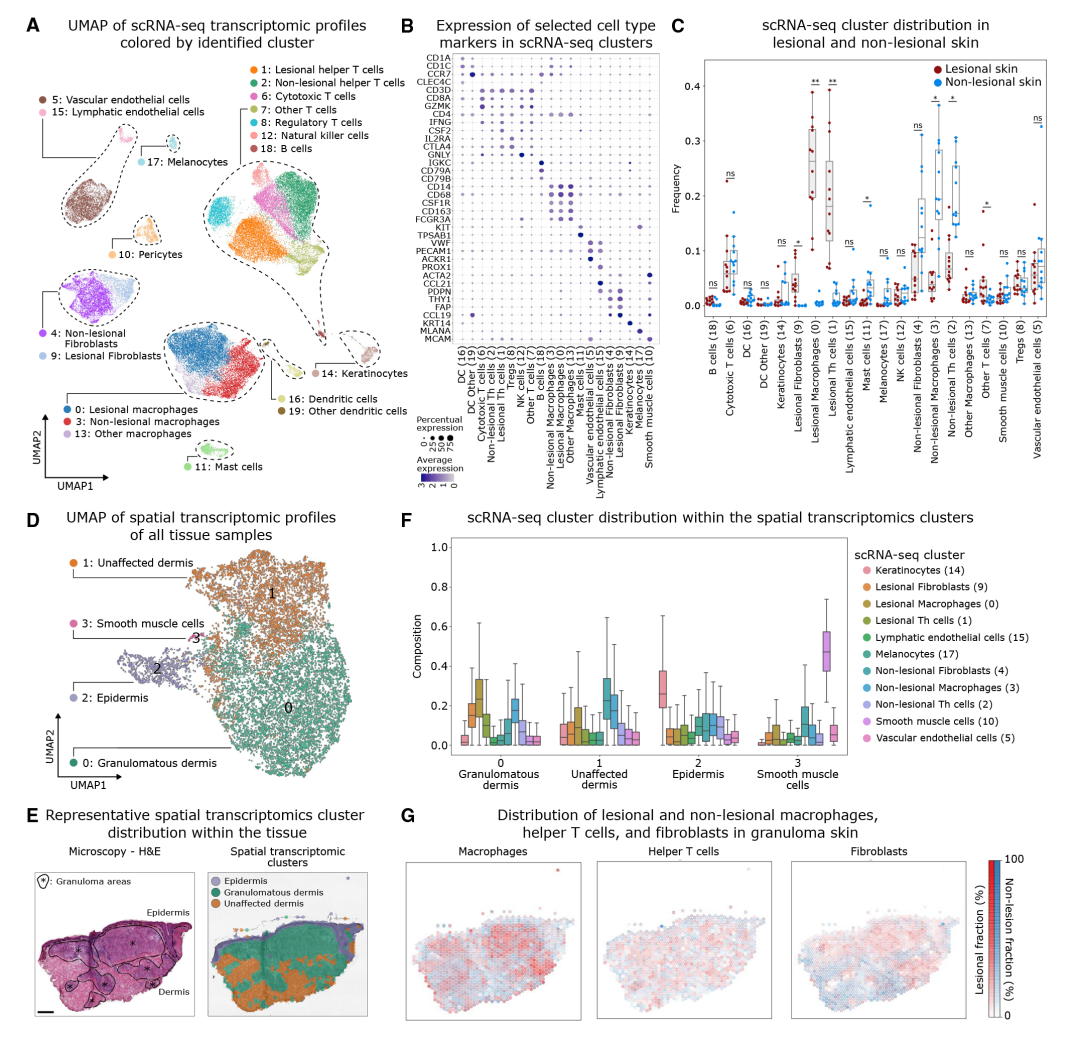
图2 细胞聚类及关键细胞簇锁定
3. GA巨噬细胞显示出强烈的促炎特征
作者对所有巨噬细胞的单细胞转录组谱进行了降维和无监督聚类,产生了两个主要的亚群。簇0(含两个巨噬细胞亚群)中的细胞来自病变皮肤,而簇1(骨髓细胞)中的细胞主要来自非病变皮肤。CD14,FCGR3A(编码CD16)和APOC1的mRNA表达较高,与白细胞介素-1相关的基因水平降低。因此,作者将簇0相关的骨髓细胞定义为“肉芽肿相关(GA)巨噬细胞”,将簇1的细胞称为“稳态巨噬细胞”。
GA巨噬细胞显示ACE(结节病血清标志物),CHI3L1,CHIT1,CYP27A1和CYP27B1的高mRNA表达,GA巨噬细胞也表达S100A8和S100A9水平升高(编码钙卫蛋白)。此外,GA巨噬细胞高度表达IFNGR1,并显示出与IFN-g激活的巨噬细胞相关的基因上调(CCL5,CXCL9,CXCL10等基因),细胞裂解和溶酶体(LAMP2和LYZ)以及ECM组分(FN1,OSM和SPP1)的基因上调。
为了进一步表征GA巨噬细胞,作者重新聚集了所有巨噬细胞并确定了两个病变亚簇:GA巨噬细胞簇GA0和GA1。作者在簇GA0中检测到几种结节病相关基因(ACE,CHI3L1,CHIT1,CYP27A1和CYP27B1)的更高表达,并且将GA0巨噬细胞基因标记专门定位于结节病肉芽肿。簇GA0中金属蛋白酶(MMP9,MMP12和MMP14)的表达增加,相同的基因在簇GA1中下调。这些结果表明,GA1和GA0巨噬细胞在调节肉芽肿内免疫细胞运输和维持的能力方面存在功能异质性。GA0巨噬细胞还表达CSF1基因,该基因编码巨噬细胞集落刺激因子(M-CSF),是巨噬细胞存活、分化和增殖的重要因子。综上,肉芽肿内部存在由GA巨噬细胞塑造的高度炎症环境。这些巨噬细胞支持适应性免疫反应和ECM重塑,从而有助于肉芽肿持续炎症的微环境。
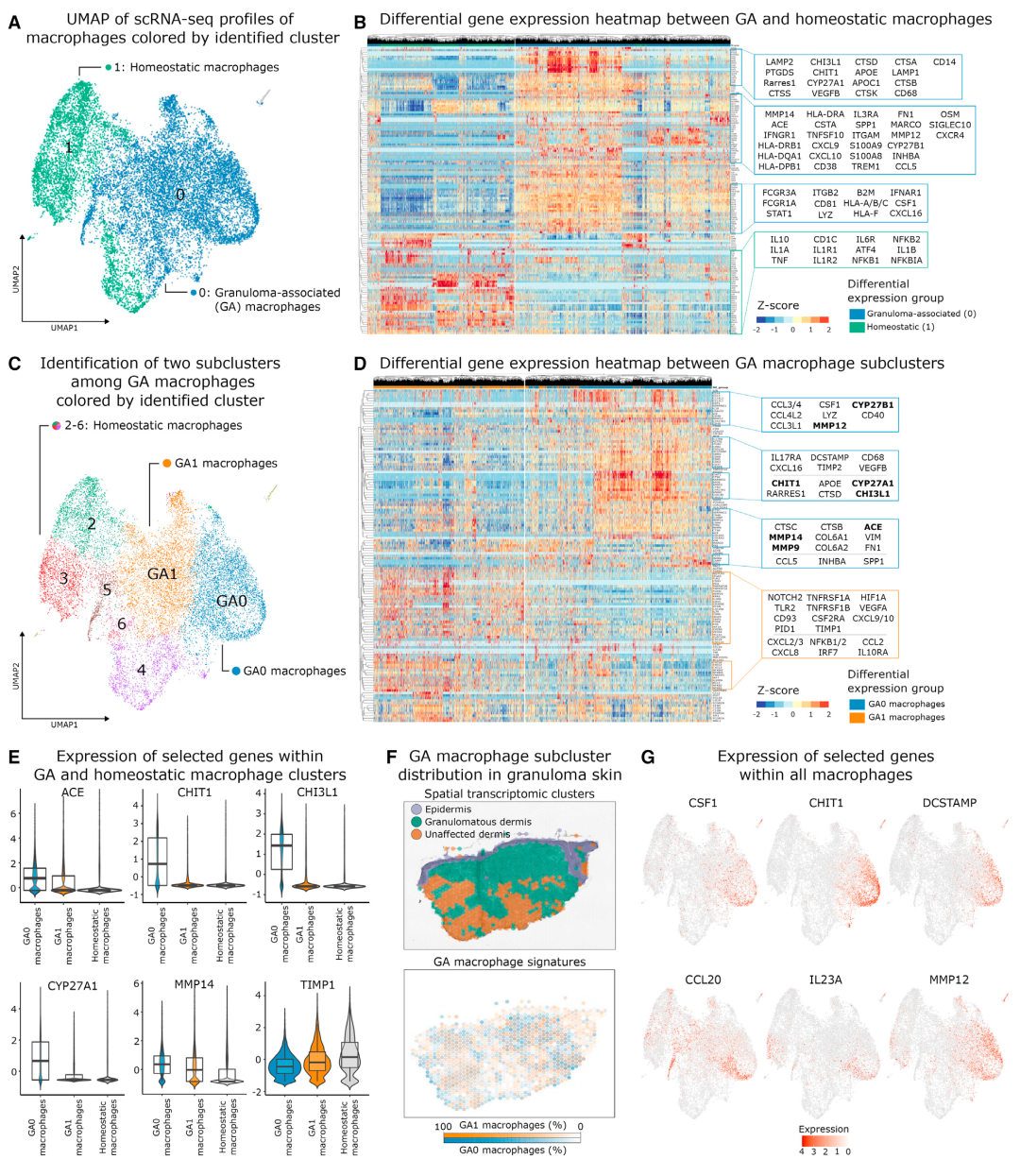
图3 巨噬细胞亚聚类及肉芽肿相关巨噬细胞的基因表达和通路分析
4. 具有Th17.1表型的T细胞富含肉芽肿
数据鉴定了七个淋巴细胞簇,包括辅助性T细胞(簇0,1和6),调节性T细胞(簇2),细胞毒性CD8 T细胞(簇3)和NK细胞(簇5)。簇4的T细胞表现出具有辅助性T细胞和细胞毒性T细胞特征(CD3、CD4、CD8和GZMK)的混合表型,称它们为其他T细胞。簇 0 的辅助T细胞由病变和非病变皮肤细胞组成,而簇1的细胞主要来源于病变皮肤(图 4A)。因此,作者将簇0命名为稳态辅助性T细胞,将簇1命名为GA辅助性T细胞。这些观察结果表明,肉芽肿包含多种T细胞亚群,GA辅助性T细胞构成肉芽肿特异性细胞亚群。通过基因表达分析(趋化因子、细胞因子、淋巴毒素相关基因)和基因集富集分析(IFN-g 信号传导、糖酵解、TCR信号传导上调,细胞自噬、细胞迁移皮质类固醇反应下调),GA辅助性T细胞存在Th17.1细胞特征,转录因子T-bet(由TBX21编码)和Rorγt(由RORC编码)在GA辅助性T细胞和肉芽肿性皮肤中共同表达。Th17.1细胞通过CCL20-CCR6轴募集到炎症部位,其中CCL20由骨髓细胞产生,其受体CCR6在T细胞上表达。免疫荧光蛋白染色在位于肉芽肿内的CD3+ T细胞上检测到CCR6表达。综上,肉芽肿内的持续刺激导致辅助T细胞向促进巨噬细胞活化和炎症反应的Th17.1细胞分化。
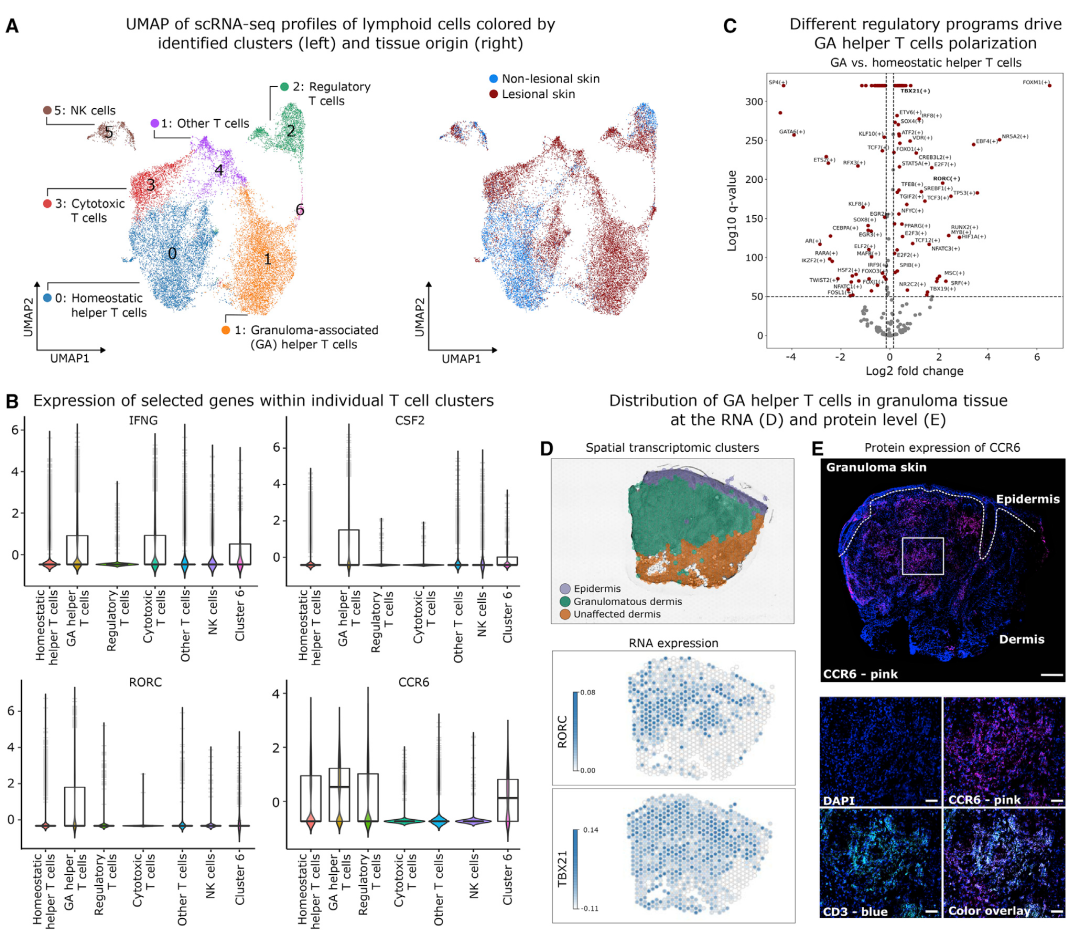
图4 GA辅助性T细胞具有Th17.1细胞的炎症特性
5. 结构细胞促进肉芽肿的局部炎症和组织重塑
与巨噬细胞或T细胞相比,病变和非病变皮肤之间的内皮细胞在转录表达上更相近。在成纤维细胞中,作者确定了三个簇。根据细胞来源,聚类0称为“稳态成纤维细胞”,将聚类1称为“GA成纤维细胞”,而聚类2是“其他成纤维细胞”。在GA成纤维细胞中,观察到OSMR表达更高,该基因促进促炎因子FAP,PDPN和THY1的表达,这些因子也在从慢性发炎组织中分离的成纤维细胞中表达。总体而言,作者观察到GA成纤维细胞中的细胞异质性高于稳态成纤维细胞,部分原因是GA成纤维细胞中存在两个不同的亚群。根据基因表达得知,“免疫相互作用成纤维细胞”表达参与细胞募集和保留,巨噬细胞吸引和活化,抗原呈递;“组织重塑成纤维细胞”编码ECM成分的基因、以及ECM和血管生成调节因子,并影响细胞迁移,肿瘤侵袭和增殖。
在病变皮肤中,位于肉芽肿附近的 GA 成纤维细胞显示出促炎标记物FAP的高 mRNA 表达。ECM 成分分泌在肉芽肿内部发炎结构中,基质沉积和降解的动态平衡可能促进淋巴细胞运输,同时增强免疫细胞在肉芽肿内的粘附和保留。将GA成纤维细胞与稳态成纤维细胞进行了比较,GA成纤维细胞的特征在于免疫相关转录因子的表达,包括IRF8,RELB和STAT2。以及免疫相互作用(HOXC9,NR2F2和TBX15)和IFN反应(IRF3,IRF5,IRF8等基因)的富集。总之,两种GA成纤维细胞参与免疫细胞吸引、激活和保留,有助于肉芽肿形状和结构的组织重塑。

图5 GA成纤维细胞的亚聚类及免疫表达分析
6. 免疫细胞和结构细胞的细胞交流定义了肉芽肿结构
基于各细胞类型间的受配体分析,GA 巨噬细胞、T 细胞和成纤维细胞表达多种趋化因子和趋化因子受体,它们可预测细胞间相互作用。几种炎症相关相互作用的基因显著富集在空间转录组的肉芽肿数据中。GA 辅助T细胞表达 IFNG,其作用于表达IFNGR1的巨噬细胞和结构细胞;GA辅助T细胞也表达 LTB,而相应的受体LTBR在巨噬细胞、成纤维细胞和内皮细胞中表达。PECAM1(编码CD31)在内皮细胞中表达,与肉芽肿内表达CD38的GA巨噬细胞和GA辅助T细胞的相互作用,并且这种相互作用通过免疫荧光蛋白染色得到证实。各种集成素在成纤维细胞(CD44、ITGA9),T细胞(ITGA4、CD49d)和内皮细胞(ITGAV、ITGA5和ITGA9)中表达,它们介导ECM组分基因(FN1、SPP1和TNC)和胶原蛋白。
另外,作者观察到几种免疫调节机制的显着富集。GA成纤维细胞和GA辅助T细胞中DPP4高表达;其次,免疫调节基因CTLA4在T细胞中高表达,其相互作用基因CD80和CD86在肉芽肿结构内的 GA 巨噬细胞上表达;第三,在肉芽肿内观察到PDCD1(编码免疫检查点受体 PD-1)和CD274(编码相应配体 PD-L1)的高表达。最后,IL23和IL23R在肉芽肿中也高度表达,可能有助于创造利于Th17.1细胞表型的细胞环境。
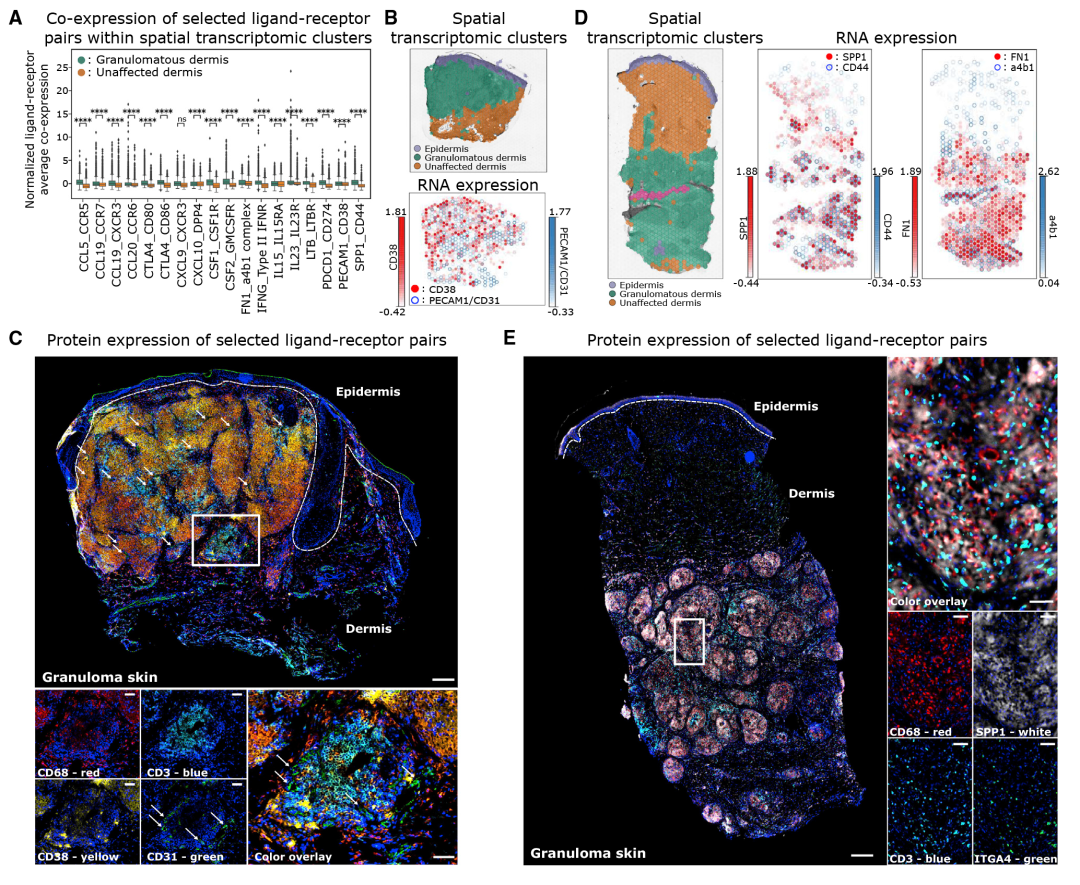
图6 不同细胞间互作串扰影响了肉芽肿的结构
7. 肉芽肿与三级淋巴结构(TLS)共享关键特征
研究数据揭示了肉芽肿和三级淋巴结构(TLS)之间的相似之处,TLS是非淋巴组织中的淋巴聚集体,在肿瘤或感染部位附近形成并有助于有效的免疫反应。数据显示,12种趋化因子验证了肉芽肿和TLS之间的全局转录表达相似性,并在肉芽肿中高表达:CCL5、CXCL9 和CXCL10在GA巨噬细胞中上调,CCL4和CCL5在GA T细胞中上调,CCL5、CCL19、CXCL9、CXCL10以及 CXCL11在GA成纤维细胞中上调。因此,肉芽肿形成构成了淋巴器官的失调和异常形式。
将肺肉芽肿、眼眶脂肪组织、泪腺组织和进行性纤维化肺肉芽肿组织的bulk RNA-seq数据与皮肤肉芽肿的scRNA-seq数据进行比较分析,多种调节基因进行跨组织类型的表达:CXCR4、HLA-DRB1、HLADQA1、JUNB、LYZ、PARP14、SOCS3、SOD2和TYMP。且同样参与Th17.1细胞信号、巨噬细胞激活、TLS形成和和 ECM重塑。
作者为验证上述结果,使用肉芽肿形成小鼠模型在药理学上用药物FPA-014(靶向作用于基质金属蛋白酶 MMP12)处理。与对照治疗相比,用MMP12抑制剂FPA-014治疗小鼠4周后,肉芽肿诱导的四肢和尾部皮肤肿胀显着减少。这些结果支持基质金属蛋白酶在肉芽肿形成和维持中的功能性贡献,可能是由基质金属蛋白酶作为ECM调节剂和免疫细胞激活剂而介导的。
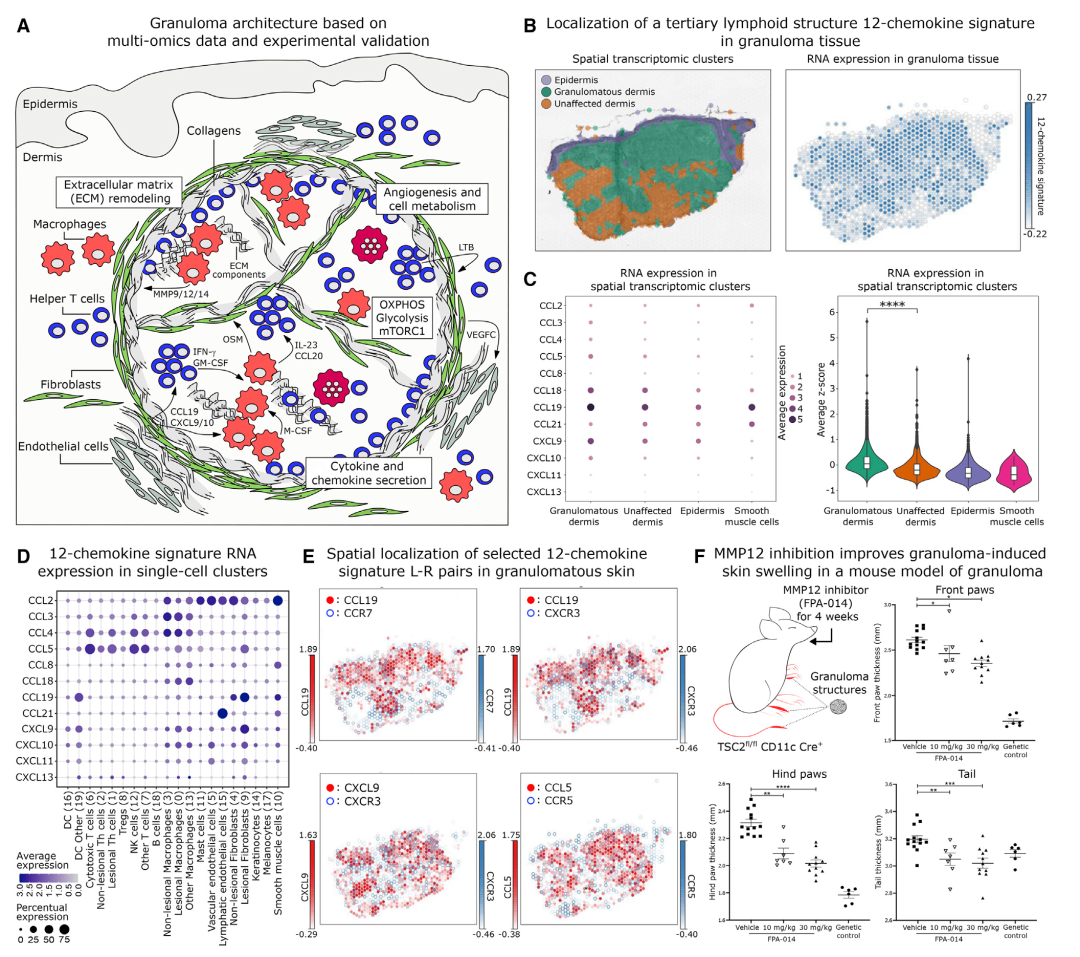
图7 肉芽肿跨组织的TLS特征及小鼠模型验证
小编小结
本研究采用单细胞转录组测序+空间转录组测序的时空组学联合模式,对肉芽肿组织中免疫细胞类型进行探究。通过联合分析其他组织中肉芽肿的bulk转录组数据,结合小鼠验证实验,证明肉芽肿相关巨噬细胞、辅助T细胞和成纤维细胞发生密切的细胞交流,并形成异常的TLS。肉芽肿转录调节进程由三个关键过程驱动:免疫代谢的变化,细胞因子和趋化因子途径的改变以及集成素和ECM的调节。作者的分析创建了非感染性肉芽肿的综合分子和空间景观,并为肉芽肿形成背后的生物学过程的治疗靶向提供了丰富的数据支撑。
